
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肝移植中心吴泓教授及兰天副教授团队在JACS 发文 提出了一种新型可控性肝癌三联治疗手段
【字体: 大 中 小 】 时间:2025年01月15日 来源:四川大学华西医院
编辑推荐:
2025年1月,我院肝移植中心吴泓教授及兰天副教授团队在Journal of the American Chemical Society(JACS)( IF:14.5)以封面文章(Cover article)的形式发表题为Synergistic Ultrasound-Activable A...

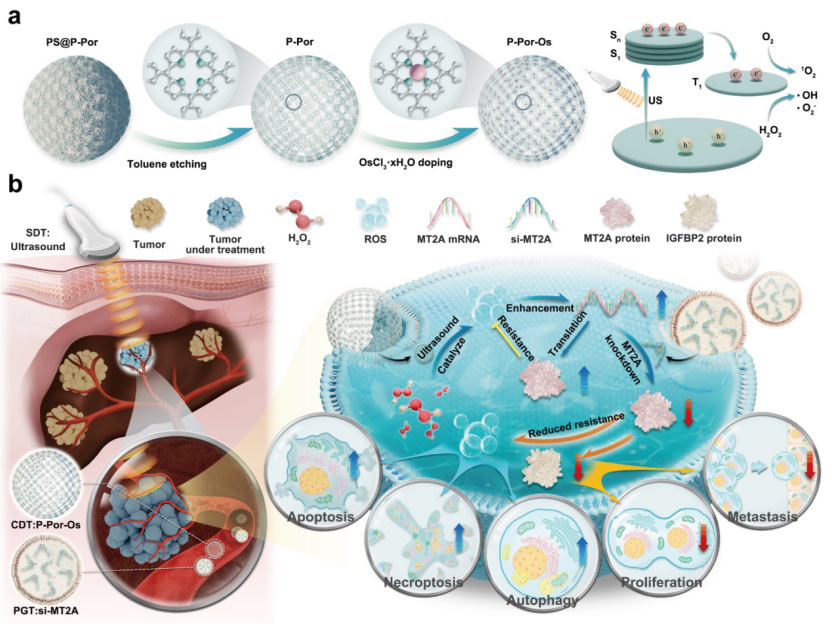
2025年1月,我院肝移植中心吴泓教授及兰天副教授团队在Journal of the American Chemical Society(JACS)( IF:14.5)以封面文章(Cover article)的形式发表题为Synergistic Ultrasound-Activable Artificial Enzyme and Precision Gene Therapy to Suppress Redox Homeostasis and Malignant Phenotypes for Controllably Combating Hepatocellular Carcinoma的研究性论文。该研究提出了一种新型肝癌治疗策略——通过开发一种新型人工纳米仿酶,结合超声波的激发,并进一步联合精准基因治疗,创新性地提出了以“CDT+SDT+PGT”为核心的新型可控性肝癌三联治疗手段。
在癌症诊疗领域,纳米医学让癌症的诊断和治疗发生了很大的改变,也显著提升了患者的治疗效果。肝细胞癌(Hepatocellular carcinoma,简称HCC)作为全球最常见的肝癌类型之一,因其高度的转移性和广泛的扩散能力,给临床治疗带来了极大的挑战。随着早期诊断和治疗方法的不断改进,HCC的治疗策略也在不断进化,尤其是多模式治疗的应用受到了越来越多的关注。近期,一项结合超声(US)激活人工酶和精准基因治疗的新型疗法为肝细胞癌的临床治疗带来了希望,并展现了巨大的潜力。该技术运用治疗性超声(US)以低治疗浓度和无害激发强度按需生成活性氧(ROS)成为HCC治疗的理想策略。
在该研究中,作者开发了一种新型的人工酶——P-Por-Os。这种基于铂金属元素(Os)设计的人工酶,具有强大的电子传输能力和高度暴露的活性位点,可以有效地在肿瘤微环境(TME)的酸性环境中催化过氧化氢(H2O2)生成ROS。在低强度超声辐照的作用下,这一催化过程被显著放大,所产生的ROS不仅能够破坏肿瘤细胞的氧化还原平衡,还能转化为单线态氧,进一步促进肿瘤细胞的死亡。这种精准控制肿瘤细胞死亡的方式及低剂量的给药方式,不仅提高了治疗的效率,也减少了对正常组织的损伤。
此外,该研究还结合了精准基因治疗(PGT)策略,以进一步增强治疗效果。众所周知,MT2A在肝细胞癌中的高表达被认为是肿瘤细胞对ROS抗性的重要因素,因此通过敲低MT2A,可以显著增强肿瘤细胞对ROS的敏感性,从而进一步提高治疗效果。基因的敲低还使得与MT2A下游基因IGFBP2相关的肿瘤恶性表型得到了有效抑制。IGFBP2的高表达与多种癌症的发生和进展密切相关,尤其在肝细胞癌中,IGFBP2的表达与肿瘤等级和患者生存期密切相关。通过精准基因干预,研究不仅成功增强了肿瘤的治疗反应,还降低了肿瘤细胞的增殖和迁移能力。
本文通讯作者为我院肝移植中心吴泓教授、兰天副教授,第一作者为肝脏数智转化研究室博士后吕应浩。该研究工作得到了国家自然科学基金、四川省科技厅、国家博新计划等项目的资助。
链接:https://pubs.acs.org/doi/10.1021/jacs.4c10997?articleRef=control