
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Science Advances | 符传孩教授课题组揭示微管细胞骨架调控新机制
【字体: 大 中 小 】 时间:2025年01月07日 来源:中国科学技术大学 | 生命科学与医学部
编辑推荐:
研究成果以“ Klp2-mediated Rsp1-Mto1 colocalization inhibits microtubule-dependent microtubule assembly in fission yeast” 为题,于 2025 年 1 月 3 日在线发表在《 Science Advances 》,为理解细胞内微管阵列的形成提供了新的见解
微管细胞骨架存在于几乎所有真核细胞,是维持细胞形态的重要亚细胞结构;同时也作为细胞内物质运输的轨道,在多种生命活动过程中发挥重要功能,与肿瘤的发生发展息息相关。中心体是细胞内为人们所熟知一类微管组织中心(MTOCs),介导微管组装。随着研究方法和成像技术的进步,越来越多的证据表明细胞内存在除中心体以外的微管组织中心,称为非中心体微管组织中心,包括多种亚细胞结构,如细胞核膜,高尔基体以及已经存在的微管等。然而,非中心体微管组织中心的作用和调控机制仍不明晰。符传孩教授课题组以裂殖酵母(Schizosaccharomyces pombe)为模式生物,综合利用酵母遗传学、高分辨活细胞显微镜、细胞生物学、生物化学等交叉学科方法和技术手段,聚焦研究非中心体微管组织中心作用及微管动态调控机制。
研究表明向微管负末端运动的驱动蛋白14家族蛋白 Klp2,在形成新微管阵列过程发挥重要调控功能。在现存微管上形成新的微管需要Mto1-Mto2复合物。本课题组前期的研究表明含有J-domain的微管组装抑制因子Rsp1(分子伴侣Hsp70/Ssa1的辅助蛋白)的过表达会破坏Mto1在微管上的定位,从而抑制微管组装 (Shen et al., 2019)。Rsp1还调控细胞分裂过程赤道板处后期微管阵列的去组装(Zimmerman et al., 2004)。然而,Rsp1如何靶向定位于现存微管上的Mto1并发挥抑制微管组装的功能仍然不清楚。研究团队针对该问题,解析了Klp2和Rsp1协同调控在现存微管上形成新微管的具体作用机制。首先,研究团队明确了Rsp1与Klp2之间相互作用的关系,并揭示二者在微管上共定位;发现Klp2缺失导致Rsp1无法正确定位到微管壁,但Rsp1缺失不影响Klp2在微管上的定位。Klp2缺失导致微管依赖性的微管成核增加。Klp2缺失不影响Mto1在微管上的定位,但Klp2的缺失减少了Rsp1和Mto1在微管上的共定位。然后,研究团队利用高时间分辨率活细胞显微镜成像,观察到Rsp1被Klp2招募至微管并沿着微管向其负末端运动。当Klp2-Rsp1运动到Mto1处时,Rsp1从Klp2上释放,并定位到Mto1处,而Klp2则继续向微管负末端运动。利用全内反射显微镜(TIRFM)开展的体外实验也证明了Klp2招募并运输Rsp1。最后,研究团队利用体外生化实验证明了Rsp1-Ssa1通过抑制Mto1-Mto2与γ-微管蛋白小复合物(γ-TuSC)的相互作用,从而抑制γ-TuSC起始微管成核的能力。综上,本研究结果表明,驱动蛋白Klp2通过将分子伴侣蛋白Rsp1靶向促微管生长因子Mto1,进而负调非中心体微管组织中心的活性,为理解非中心体微管组装调控机制提供了新的见解。
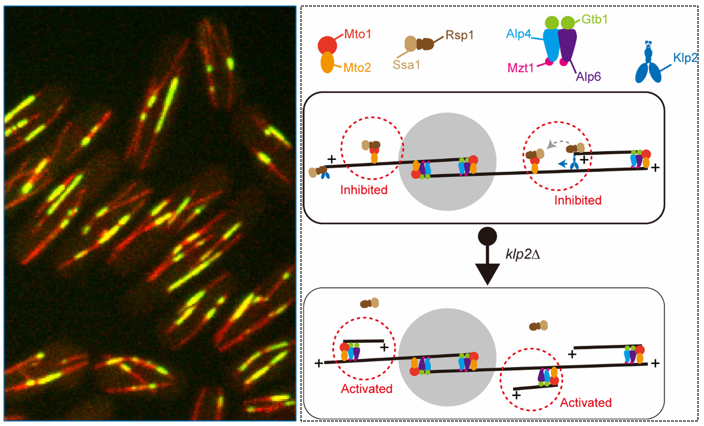
图注:左图为利用高分辨活细胞显微镜观察的裂殖酵母细胞中反平行微管阵列,绿色为标记反平行微管重叠区的Ase1-GFP蛋白,红色为微管。右图为微管上生成新微管的调控模式图。在野生型细胞中,Klp2负责将Rsp1-Ssa1招募至微管,并将其向微管负末端运输,当Klp2-Rsp1-Ssa1到达Mto1-Mto2处时,Rsp1-Ssa1与Mto1-Mto2结合,并抑制Mto1-Mto2招募γ-TuSC的功能,从而抑制微管上微管的组装。在Klp2缺失的细胞(klp2?)中,Rsp1-Ssa1无法正确定位到微管上Mto1-Mto2处,因此Mto1-Mto2介导的微管上微管的组装增强。
研究成果以“Klp2-mediated Rsp1-Mto1 colocalization inhibits microtubule-dependent microtubule assembly in fission yeast”为题,于2025年1月3日在线发表在《Science Advances》,为理解细胞内微管阵列的形成提供了新的见解。

中国科学技术大学生命科学与医学部符传孩教授、符传孩课题组博士后郑圣男和武汉大学姜恺教授为该论文的共同通讯作者。中国科学技术大学生命科学与医学部符传孩课题组博士生聂凌云和已毕业博士生刘文跃为该论文的共同第一作者。中国科学技术大学生命科学与医学部姚雪彪、刘行以及项晟祺教授均给予了重要帮助。该工作得到无膜细胞器与细胞动力学教育部重点实验室、合肥微尺度国家研究中心分子与细胞生物物理研究部、安徽省化学生物学与新质医学重点实验室的大力支持,得到国家重点研发计划、国家自然科学基金、中央高校基础科研业务费专项资金、中国博士后科学基金等项目资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.adq0670