
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nat Nanotechnol 丨 上海药物所合作揭示胆固醇在外泌体递释RNA药物中的关键作用
【字体: 大 中 小 】 时间:2024年09月21日 来源:中国科学院上海药物研究所
编辑推荐:
2024年9月19日,中国科学院上海药物研究所甘勇研究员、俞淼荣副研究员与浙江大学胡国庆教授团队合作在Nature Nanotechnology上在线发表了题为“Direct Cytosolic Delivery of siRNA via Cell Membrane Fusion Using Cholesterol-Enriched Exosomes“的研究论文
2024年9月19日,中国科学院上海药物研究所甘勇研究员、俞淼荣副研究员与浙江大学胡国庆教授团队合作在Nature Nanotechnology上在线发表了题为“Direct Cytosolic Delivery of siRNA via Cell Membrane Fusion Using Cholesterol-Enriched Exosomes“的研究论文。该研究结合理论建模和实验研究深入揭示了胆固醇在调控外泌体递释RNA药物中的关键作用及其背后的机制,并开发出高效的工程化外泌体RNA递释系统,为基因治疗提供了一种安全高效的创新递释策略。
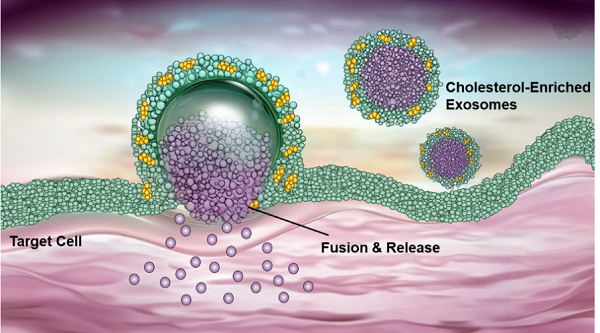
图1. 富含胆固醇的外泌体递释RNA药物示意图
近年来,RNA干扰(RNAi)技术在基因表达调控领域潜力巨大,逐渐成为治疗遗传性疾病和癌症等重大疾病的前沿技术。然而,RNA的递释效率及其安全性一直是其临床应用中的关键难题。虽然已有如N-乙酰半乳糖胺(GalNAc)和脂质纳米颗粒(LNP)等RNA递释系统在临床使用,但它们在细胞内溶酶体的逃逸效率仍然较低(仅为1-4%),限制了其疗效。
外泌体作为天然的纳米级细胞外囊泡,因其出色的生物相容性、稳定性、长效的体内循环时间以及精准的组织靶向能力,逐渐成为优化RNA递释的研究热点。然而,天然外泌体进入细胞主要依赖内吞作用,导致RNA分子易在溶酶体中被迅速降解,从而限制了其递释效率。
为克服这一难题,研究团队创新性地采用外泌体工程化可控修饰策略,定量化调控了不同种类外泌体中胆固醇的含量(如牛奶外泌体、生姜外泌体、肿瘤细胞来源的外泌体等),并利用透射电子显微镜等技术对其进行了全面表征。研究结果表明,外泌体膜中胆固醇含量的增加显著增强了其与靶细胞膜的相互作用,促使外泌体通过膜融合而非内吞途径进入细胞,大幅降低了溶酶体降解的限制。分子模拟研究同时揭示,富含胆固醇的外泌体具有更强的膜变形能力,能扩大其与细胞膜的接触面积,从而通过膜融合机制将小干扰RNA(siRNA)直接高效递送至细胞质内。
在体外实验中,富含30%胆固醇的牛奶外泌体(30% Chol/MEs)成功递送了PLK1 siRNA,显著下调了PLK1 mRNA和蛋白表达水平,诱导了肿瘤细胞凋亡,其效果明显优于传统的转染试剂Lipo 2000和RNAiMAX。体内实验进一步证实,30% Chol/MEs/siPLK1通过口服或静脉注射方式,在小鼠结直肠肿瘤模型中均能有效抑制肿瘤生长,展示了其作为基因治疗载体的良好潜力。

图2. 富含胆固醇的外泌体通过膜融合高效递释RNA及微观机制
甘勇研究团队近年来在药物载体高效递释的物理药剂学研究领域取得了显著进展,相关论文已发表在Nature Communications(2018, 2022, 2024), PNAS (2019, 2024) ,?Science Advances (2020)等国际主流期刊,揭示了形状、刚度和表面性质等物理属性影响载体输运效率和靶位释放的规律及微观机制,为理性化设计高效递释的药物载体提供了新思路。
上海药物所-南昌大学联合培养硕士研究生卓岩和浙江大学博士研究生骆珍为本文共同第一作者,上海药物所甘勇研究员、俞淼荣副研究员和浙江大学胡国庆教授为本文共同通讯作者。该研究获得了中国科学院上海高等研究院国家蛋白质科学研究(上海)设施的技术支持,以及国家杰出青年科学基金、国家重点研发计划项目、上海市重点项目、国家生物药技术创新中心“揭榜挂帅”技术攻关项目等资助。
原文链接:https://www.nature.com/articles/s41565-024-01785-0
(供稿部门:甘勇课题组)