
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Science:靶向13种KRAS突变的蛋白水解靶向嵌合体(PROTAC)设计
【字体: 大 中 小 】 时间:2024年09月20日 来源:AAAS
编辑推荐:
KRAS基因突变是癌症发展和转移生长的驱动因素之一。来自勃林格殷格翰和英国邓迪大学的研究人员在新一期的《Science》上介绍了一种可以降解多种KRAS突变的蛋白水解靶向嵌合体(PROTAC)的设计,可让17种最常见的KRAS突变中的13种失活
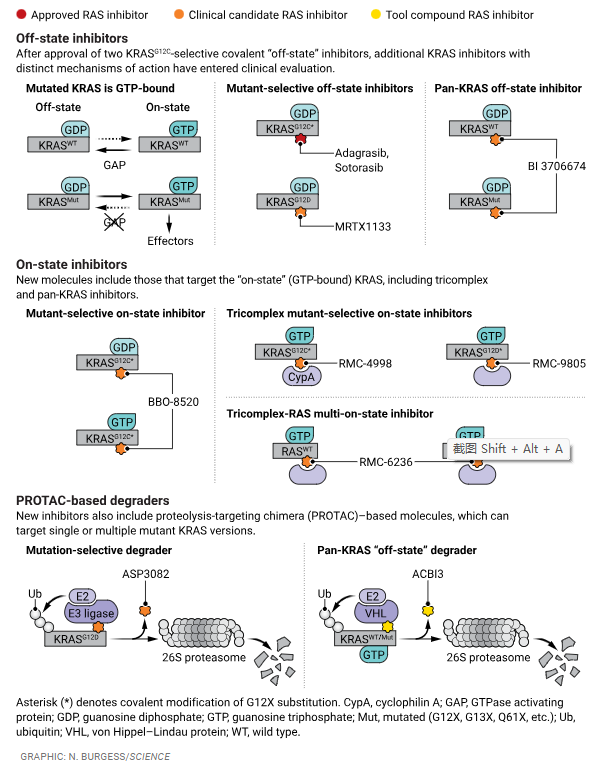
KRAS基因突变是癌症发展和转移生长的驱动因素之一,一度曾被认为是"无法治疗的",现在已有两种获批药物sotorasib和adagrasib可阻断一种特定突变KRASG12C(第12位的甘氨酸被半胱氨酸取代)的活性。在KRAS发现了一个以前不为人知可用药物靶向的“口袋”,使靶向药物的开发成为可能,并促使人们努力开发更多类型的抑制剂以靶向在癌症中更为普遍的各种KRAS突变。来自勃林格殷格翰和英国邓迪大学的研究人员在新一期的《Science》上介绍了一种可以降解多种KRAS突变的蛋白水解靶向嵌合体(PROTAC)的设计。这种单一分子可以将17种最常见的KRAS突变体中的13种失活,包括癌症最常见的KRASG12D(D,天冬氨酸),并且可能有助于确定抑制或降解KRAS是否具有更好的治疗效果。
KRASG12C抑制剂的发展促进了人们努力寻找新的KRAS抑制剂,特别是靶向KRASG12D的抑制剂。目前,至少有9个KRASG12D-选择性抑制剂(ASP3082、ASP4396、GFH375/VS-7375、HRS-4642、INCB161734、MRTX1133、QTX3046、rmmc -9805和TSN1611)正在临床评估中。值得注意的是,KRASG12C抑制剂是该突变体的永久共价修饰剂,但是KRASG12D-选择性抑制剂除一种之外其他都是非共价的,因为G12D(天冬氨酸)取代产生的活性氨基酸位点要比G12C(半胱氨酸)突变少。例如,MRTX1133是一种非共价变构抑制剂,在KRAS G12D处于关闭状态时结合“Shokat”开关II口袋(SIIP)。相比之下,rmmc -9805可识别KRASG12D的“打开”状态,与cyclophilin A形成初始二元复合物,然后识别KRAS形成三复合物( tricomplex),是共价变构抑制剂。ASP3082是一个蛋白水解靶向嵌合体(PROTAC),包含KRASG12D-选择性的结合配体,通过连接子连接到E3泛素连接酶结合元件,该元件招募E3连接酶来引起泛素化和蛋白酶介导的KRASG12D 降解。
传统的观念是,需要一种选择性针对突变KRAS的抑制剂来实现靶向癌细胞的最佳治疗指数,同时保留正常细胞。然而,这种针对突变的选择性抑制剂的倾向受到了挑战,其一来自意想不到的(尽管是低水平的)毒性,其二来自非突变选择性抑制剂的令人期待的观察结果。“泛KRAS”抑制剂BI-2865和BI-2493,对大多数KRAS突变体和正常KRAS都表现出效力,更有效的类似物BI-3706674已进入临床评估(NCT06056024)。RAS“多重抑制剂”,如rmmc -6236,可以同时靶向突变和正常形式的KRAS类似物——HRAS和NRAS。rmmc -6236在早期1期评估中显示出有希望的结果。
Popow等人提出的靶向不同KRAS突变蛋白的PROTAC的策略,体现在泛KRAS关闭状态抑制剂BI-2865,它可以阻断多种KRAS突变。BI-2865的SIIP结合基序(binding motif)与VHL E3连接酶结合基序通过连接子偶联。基于结构的设计确定了一个初始化合物4,该化合物对17种最常见的KRAS突变中的13种表现出高活性,包括KRASG12D。将这个KRAS降解化合物4 与一种同样结合并抑制KRAS但缺乏降解活性的相关化合物(对照)进行比较,发现这个降解化合物4 抑制KRAS的效力提高了10倍,并且持久性更长。而一种旨在增强化合物4 体内特性的化合物,命名为ACBI3,在小鼠异种移植模型中能够有效抑制基于KRASG12D的突变型结直肠癌和KRASG12V突变(V,缬氨酸)的卵巢平滑肌肉瘤的肿瘤生长。然而,ACBI3并没有直接在体内与不能降解KRAS的对照抑制剂进行比较,因此其肿瘤消退能力在多大程度上是由于其降解特性尚不清楚。
基于PROTAC的KRAS抑制剂可能比变构抑制剂有几个优点。识别KRAS的部分本身并不需要损害KRAS的功能,这扩大了KRAS抑制剂的化学谱。此外,PROTACs不需要高亲和力的化学计量结合。PROTAC诱导的降解消除了所有KRAS功能。一旦KRAS被降解,PROTAC就具有催化作用,可以降解其他靶标,从而降低所需的有效剂量。相反,基于PROTAC的KRAS抑制剂也有潜在的局限性。"双弹头"的性质需要构建更高分子量的复杂分子,这降低了细胞的渗透性和生物利用度。在Popow描述的小鼠研究中,ACBI3需要皮下或腹腔内给药。ASP3082是基于PROTAC的KRASG12D选择性化合物,需要静脉注射,这对需要频繁、长期治疗的药物是一个很大的限制。相比之下,已经获批的adagrasib和sotorasib是口服的。
KRAS抑制剂容易发生原发性和治疗性获得性耐药。KRASG12C抑制剂治疗后复发患者循环肿瘤DNA揭示了复杂的遗传机制,包括KRAS突变在药物结合中受损或在打开状态下增强,以及RAS上游或下游增强KRAS效应信号传导的突变。基于PROTAC的KRAS降解复合物很可能会受到这些机制的影响。此外,这些化合物与E3连接酶结合的要求增加了E3表达的丧失,这是抗性的潜在机制。
基于PROTAC的泛KRAS抑制剂的开发扩大了直接KRAS抑制剂的机制多样性。目前,有30多种针对KRAS的治疗方法正在进行临床评估,而且肯定会有更多的治疗方法出现。例如,正在考虑其他非蛋白酶体的降解策略。是否存在一个(或多个)“最佳”机制?鉴于KRAS的致癌功能根据特定的突变和组织类型的差异,不同的KRAS抑制剂可能适合不同的情况。联合KRAS抑制剂也可能是一种可行的策略来抵消耐药性的出现。未来的分析应该评估具有抗正常KRAS活性的泛KRAS抑制剂和降解剂如何影响免疫系统和肿瘤微环境,如何避免毒性,以及如何优化大分子如PROTACs的口服给药。第一个基于PROTAC的治疗方法于2019年进入临床评估,目前有20多种此类化合物正在进行临床评估,因此KRAS加入破坏靶标是合适的。
 生物通微信公众号
生物通微信公众号
知名企业招聘