
-

生物通官微
陪你抓住生命科技
跳动的脉搏
卫涛涛研究组与合作者共同揭示核糖体蛋白RPL22驱动人干细胞衰老的分子机制
【字体: 大 中 小 】 时间:2024年09月15日 来源:中国科学院生物物理研究所
编辑推荐:
2024年9月11日,中国科学院生物物理研究所卫涛涛研究组联合中国科学院动物研究所刘光慧研究组、中国科学院北京基因组研究所张维绮研究组、中国科学院动物研究...
核糖体作为负责细胞内蛋白质合成的分子机器,在细胞的生命活动中发挥着关键作用。核糖体由核糖体RNA(rRNA)和核糖体蛋白两部分组成,此前对核糖体蛋白的功能研究主要集中于其参与个体发育及疾病发生等领域,其与衰老之间的相关性还有待深入揭示。
2024年9月11日,中国科学院生物物理研究所卫涛涛研究组联合中国科学院动物研究所刘光慧研究组、中国科学院北京基因组研究所张维绮研究组、中国科学院动物研究所曲静研究组在《Nucleic Acids Research》杂志在线发表了题为"CRISPR screening uncovers nucleolar RPL22 as a heterochromatin destabilizer and senescence driver"的研究论文。该研究利用CRISPR/Cas9基因筛选技术发现核糖体蛋白RPL22是驱动人干细胞衰老的重要因素,首次揭示了RPL22可以通过破坏核仁区域异染色质结构,引起rRNA表达增加并引发细胞衰老。
在该项研究中,研究人员首先对332个核糖体相关基因进行了基于CRISPR/Cas9技术的基因功能缺失筛选,发现了10个可能与人干细胞衰老相关的核糖体相关基因,其中核糖体蛋白RPL22与人干细胞衰老的关系最为密切,且RPL22在人间充质祖细胞衰老的过程中发生积累。
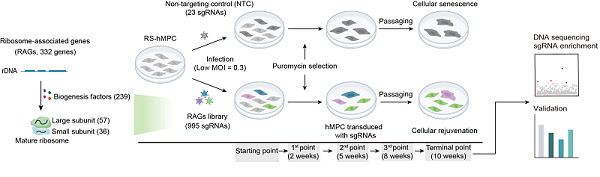
图1:基于CRISPR/Cas9技术的基因功能缺失筛选发现RPL22与人干细胞衰老相关
随后研究人员通过CRISPR/Cas9基因编辑技术和干细胞定向诱导分化技术,获得了缺失RPL22的人类胚胎干细胞和人间充质祖细胞,并发现过表达RPL22明显加速细胞衰老,而敲除RPL22则缓解细胞衰老。
为了揭示RPL22发挥作用的分子机制,研究人员首先通过SUnSET实验发现敲除RPL22的人间充质祖细胞的整体翻译水平并没有发生明显变化;随后通过构建缺失核糖体功能的RPL22突变体,发现其仍可以显著促进人间充质祖细胞的衰老,提示RPL22的促衰老能力不依赖于其核糖体功能。
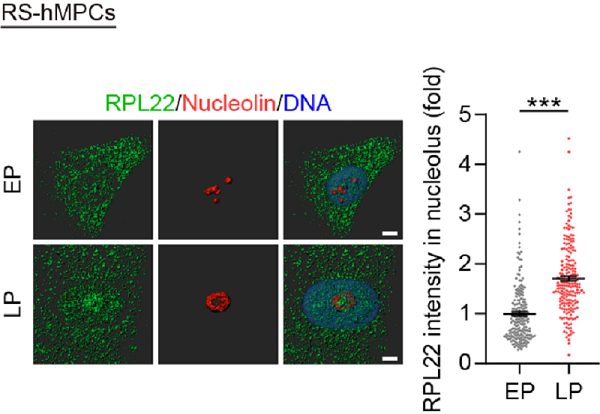
图2:RPL22在晚代细胞核仁内出现聚集
研究人员通过免疫荧光技术发现,在人干细胞衰老的过程中,RPL22在晚代细胞的核仁内发生积累;而解除RPL22的核仁定位后,RPL22失去了促进rRNA表达和促进细胞衰老的能力,这些实验结果表明RPL22的促衰老能力依赖于其核仁定位。
研究人员利用蛋白免疫共沉淀技术发现RPL22可以与异染色质蛋白KAP1和HP1γ发生蛋白相互作用,并使其表达水平下调;进一步利用ChIP-qPCR技术发现RPL22蛋白的积累会下调核仁异染色质区域异染色质蛋白KAP1、HP1γ和H3K9me3的蛋白水平,破坏核仁区域的异染色质结构;而核仁异染色质结构的破坏会引起其中本处于高度抑制状态的rDNA区域被激活,导致rRNA表达的增加,进而诱发细胞衰老。解除RPL22的核仁定位后,RPL22即失去了上述的破坏核仁异染色质、促进rRNA表达和促进细胞衰老的能力。
此外,研究人员还发现RPL22在人间充质祖细胞中的蛋白敲除可以缓解病理性衰老(HGPS和WS病理性衰老模型)、压力应激衰老模型(UV和H2O2诱导的压力应激衰老模型)和生理性衰老模型(老年人体分离的原代间充质祖细胞)等多种衰老模型的衰老表型,表明RPL22可能可以作为干预衰老和衰老相关疾病的潜在分子靶标。
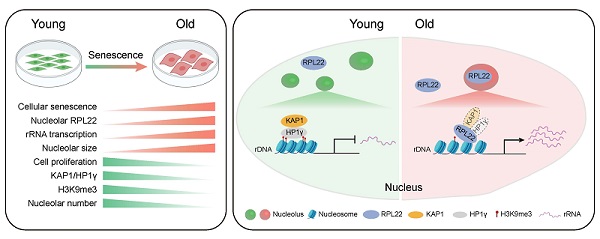
图3:RPL22下调核仁异染色质区域异染色质蛋白KAP1、HP1γ和H3K9me3的蛋白水平,破坏核仁区域的异染色质结构,进而诱发细胞衰老
综上所述,该研究通过CRISPR/Cas9基因功能缺失筛选发现RPL22是人干细胞衰老的重要驱动因子,并首次揭示了核糖体蛋白RPL22可以通过与核仁区域异染色蛋白相互作用并下调其表达进而破坏核仁异染色质的结构,上调rRNA的表达,从而促进细胞衰老的全新分子机制。此外敲除RPL22可以缓解多种衰老模型的衰老表型,表明RPL22可能作为干预衰老和衰老相关疾病的潜在分子靶标。
中国科学院生物物理研究所博士研究生李洪宇、中国科学技术大学博士研究生王敏、中国科学院动物研究所博士研究生蒋晓钰和海南医科大学荆耀彬研究员为论文的共同第一作者;中国科学院动物研究所刘光慧研究员、中国科学院生物物理研究所卫涛涛研究员、中国科学院北京基因组研究所张维绮研究员和中国科学院动物研究所曲静研究员为论文的共同通讯作者。
文章链接:https://doi.org/10.1093/nar/gkae740
?
(供稿:卫涛涛研究组)
?