
-

生物通官微
陪你抓住生命科技
跳动的脉搏
北大第三医院丁士刚团队在Gut Microbes发表最新成果,揭示幽门螺杆菌相关胃炎致病新机制
【字体: 大 中 小 】 时间:2024年09月13日 来源:北京大学新闻网
编辑推荐:
研究首次提出RNA结合蛋白AUF1通过抑制溶酶体组织蛋白酶D(CTSD)的表达来抑制CagA的自噬降解,并促进积累在细胞内的CagA进入外泌体进而引发胞外炎症的新机制,表明AUF1是CagA的一种新的宿主正向调控因子。
日前,北京大学第三医院消化科丁士刚教授、张静副教授团队与北京大学基础医学院陈香梅研究员、魏国超研究员联合在Gut Microbes(《肠道微生物》IF:12.2)杂志上在线发表题为《AUF1介导的自噬溶酶体降解抑制有助于CagA稳定性和幽门螺杆菌诱导的炎症》(“AUF1-mediated inhibition of autophagic lysosomal degradation contributes to CagA stability and Helicobacter pylori-induced inflammation”)的研究论文。研究首次提出RNA结合蛋白AUF1通过抑制溶酶体组织蛋白酶D(CTSD)的表达来抑制CagA的自噬降解,并促进积累在细胞内的CagA进入外泌体进而引发胞外炎症的新机制,表明AUF1是CagA的一种新的宿主正向调控因子。

论文截图
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种定植于胃上皮的致病菌,可引发慢性浅表性胃炎、萎缩性胃炎、肠化生、不典型增生和胃癌等胃黏膜疾病。幽门螺杆菌相关疾病的发病机制涉及宿主因素与细菌毒力因子的复杂相互作用。作为幽门螺杆菌的关键毒力因子,CagA通过IV型分泌系统直接注射到胃上皮细胞中发挥致炎作用,与此同时,宿主细胞通过自噬途径将其降解。阐明幽门螺杆菌如何抵抗宿主自噬对CagA的降解机制,将为幽门螺杆菌相关胃病的新药物研发提供潜在靶标。
本研究首先发现,幽门螺杆菌通过上调AUF1表达抑制胃上皮细胞的自噬过程。进一步的研究表明,AUF1并不影响自噬的启动,而是阻碍了自噬中的溶酶体降解过程。在幽门螺杆菌感染的胃上皮细胞中,上调的AUF1通过抑制细胞内CagA的自噬溶酶体降解来稳定CagA蛋白水平。敲低AUF1促进了CagA降解,而这一作用可以被溶酶体抑制剂BafA1和CQ逆转。转录组分析显示,敲低AUF1后,感染幽门螺杆菌的胃上皮细胞中多种溶酶体相关水解酶基因的表达显著上调,特别是CTSD的表达明显增加。机制上,AUF1与CTSD mRNA的3'UTR区域结合,AUF1的敲低增强了CTSD mRNA的稳定性。AUF1介导的CTSD表达下调有助于CagA的稳定,导致外泌体中CagA水平升高,从而促进细胞外炎症。在胃炎患者胃粘膜样本中,AUF1高表达及胞质易位与幽门螺杆菌相关胃炎患者的炎症严重程度呈正相关,而CagA是AUF1易位进入细胞质的必要条件。
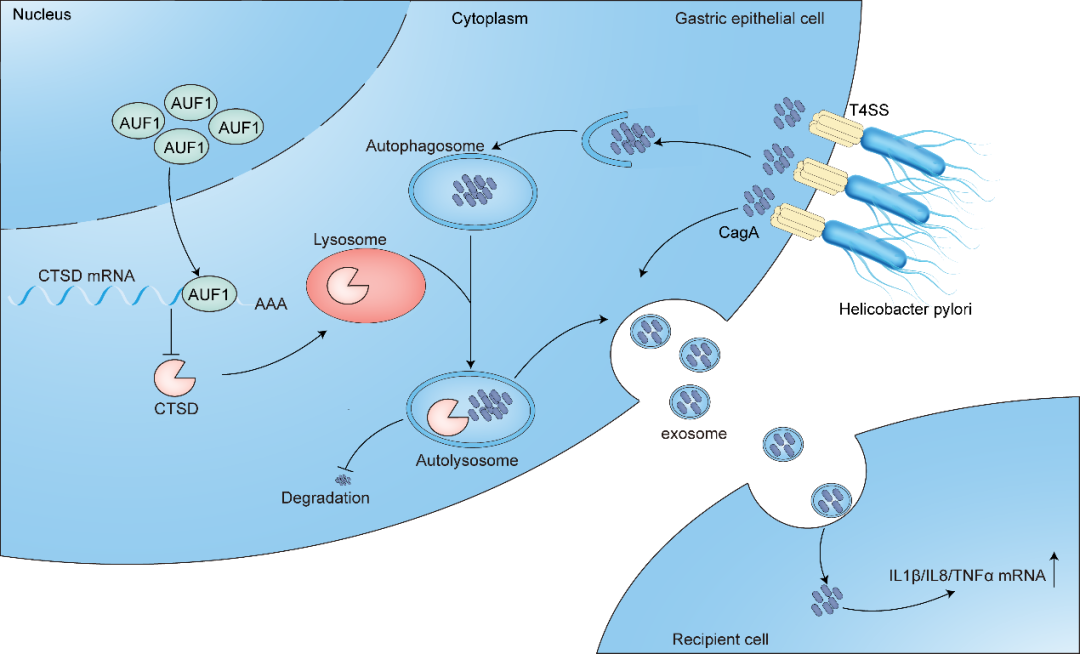
幽门螺杆菌感染过程中AUF1的作用示意图。幽门螺杆菌CagA上调AUF1的表达,促进其向细胞质的易位。同时,AUF1通过抑制CTSD的表达抑制CagA的自噬降解;细胞内的积累CagA从而被外泌出去,促进胞外炎症
综上所述,幽门螺杆菌CagA能够上调AUF1的表达并促进其向细胞质分布。同时,AUF1通过抑制CTSD表达抑制CagA的自噬降解,而在细胞内积累的CagA可通过外泌体途径外泌,从而促进细胞外炎症。该研究揭示了幽门螺杆菌关键毒力因子CagA与宿主AUF1蛋白之间的相互作用在幽门螺杆菌致病机制中的重要作用,AUF1表达失调可能增加幽门螺杆菌相关胃炎的风险。
北京大学第三医院消化科博士生郑惠玲、北京大学基础医学院教师张婷为论文的共同第一作者,丁士刚、陈香梅、张静、魏国超为论文的通讯作者,该研究受国家自然科学基金面上项目的资助。