
-

生物通官微
陪你抓住生命科技
跳动的脉搏
广东省人民医院鲁冰/赵蔚团队发表关于在乳腺癌三维基因组调控机制的研究成果
【字体: 大 中 小 】 时间:2024年09月06日 来源:南方医科大学
编辑推荐:
近日,广东省人民医院鲁冰、赵蔚团队在《Nature Cancer》上发表了题为“Phase separation of phospho-HDAC6 drives aberrant chromatin architecture in triple-negative breast cancer”的文章。该论文首次揭示了三阴性乳腺癌(TNBC)中存在磷酸化HDAC6蛋白形成的凝聚体,并提出了通过干预磷酸化HDAC6的相分离来治疗TNBC的新策略。广东省人民医院为第一单位和通讯作者单位,合作单位分…
近日,广东省人民医院鲁冰、赵蔚团队在《Nature Cancer》上发表了题为“Phase separation of phospho-HDAC6 drives aberrant chromatin architecture in triple-negative breast cancer”的文章。该论文首次揭示了三阴性乳腺癌(TNBC)中存在磷酸化HDAC6蛋白形成的凝聚体,并提出了通过干预磷酸化HDAC6的相分离来治疗TNBC的新策略。
广东省人民医院为第一单位和通讯作者单位,合作单位分别为中山大学、广州市妇女儿童中心、桂林医科大学附属医院及顺德医院。文章的第一(共同)作者为广东省人民医院的特聘副研究员鲁冰,中山大学中山医学院的博士研究生邱茹和魏嘉田,以及桂林医学院附属医院的研究员王力。李杰和赵蔚担任通讯作者。

该研究发现TNBC中磷酸化HDAC6在细胞核表达显著增加,通过对HDAC6的潜在磷酸化位点突变分析,发现Ser22的磷酸化对其核内定位至关重要,这种磷酸化状态与肿瘤的分期及转移显著相关,并与患者的总生存期负相关。一系列实验研究发现,TNBC细胞中磷酸化HDAC6倾向于在细胞核形成LLPS的凝聚体,并且主要分布在活跃的染色质区域。
研究人员通过基于相分离蛋白的筛选,发现了一种名为Nexturastat A的HDAC6抑制剂,该抑制剂能有效地抑制TNBC中磷酸化HDAC6凝聚体形成。体内外实验验证Nexturastat A通过降低磷酸化HDAC6的LLPS,从而抑制TNBC细胞的增殖、瘤球形成能力和侵袭性,同时促进细胞凋亡。Nexturastat A在体内显著抑制了TNBC的生长。此外,Nexturastat A显示出极低的非癌细胞毒性,表明其具有良好的安全性。
机制探究发现,Nexturastat A处理后TNBC细胞的全基因组染色质相互作用发生了显著变化,特别是在开放和封闭染色质区域的重新分布。此外,Nexturastat A的治疗使染色质的可及性增加,促进新的染色质环结构的形成,这些新环结构富含RNA聚合酶II(Pol II)特异性DNA结合。Nexturastat A处理还使TNBC细胞转录模式重编程,这体现在Pol II的结合增加,促使肿瘤抑制基因的表达上调,原癌基因表达下调,并且激活了与免疫反应相关的基因。
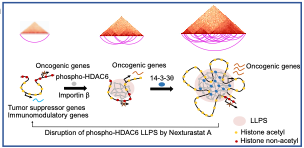
该研究揭示了磷酸化HDAC6在TNBC中的全新作用,特别是它在转录活跃区域形成的相分离凝聚体对染色质结构的影响。磷酸化HDAC6不仅改变了染色质的物理结构,还促进了特定的组蛋白乙酰化修饰和转录谱的重编程,从而推动了TNBC的恶性表型发展。这一发现不仅为我们提供了对TNBC中染色质动态复杂性的更深层理解,还提出了通过调控磷酸化HDAC6来干预TNBC的染色质结构和细胞命运治疗策略。