
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature communications | 北京大学苗蕾团队开发病灶高表达与长滞留(FORT)策略用于代谢性肝病的治疗
【字体: 大 中 小 】 时间:2024年08月30日 来源:北京大学药学院
编辑推荐:
针对MASH病灶的药物递送困境,2024年8月27日,我院天然药物及仿生药物全国重点实验室苗蕾研究员团队在Nature communications杂志发表了题为“RNA Nanotherapeutics with Fibrosis Overexpression and Retention for MASH Treatment” 的研究论文
代谢功能障碍相关脂肪性肝炎(MASH)在我国发病率高,是肝硬化和肝癌的主要诱因,严重威胁人类生命健康。具有抗炎、抗纤维化作用的重组蛋白和多肽类药物,如relaxin (RLN)、IL-10等在临床前研究中具有治疗潜力,但这些蛋白质疗法往往因清除速度快、稳定性不佳且缺乏靶向性而很难实现临床转化。此外,细胞外基质(ECM)的过度沉积形成了药物递送的屏障,大大影响药物的递送效率,导致目前MASH的治疗严重受限。

针对MASH病灶的药物递送困境,2024年8月27日,我院天然药物及仿生药物全国重点实验室苗蕾研究员团队在Nature communications杂志发表了题为“RNA Nanotherapeutics with Fibrosis Overexpression and Retention for MASH Treatment” 的研究论文。文章首次提出了纤维化病灶高表达与长滞留(Fibrosis Overexpression and Retention,FORT)策略,并实现了多种MASH模型的高效药物递送和治疗。在这一策略中,我们首先构建了基于视黄酸ATRA的脂质纳米粒(LNP)以增强纤维化区域表达,并探究了ATRA在LNP形成过程中重排并提升相关蛋白结合、增强膜融合以提升成纤维细胞的表达的机制。另一方面,我们通过对治疗性蛋白的工程化,构建了锚定于ECM的融合蛋白。通过mRNA LNP的静脉递送,所表达的融合蛋白显著延长在纤维化病灶中滞留时间并减少系统毒性。这一策略在多个临床相关的MASH动物模型中展现良好的治疗效果,对不适合直接注射蛋白的纤维化疾病具有良好的应用潜力(图1)。
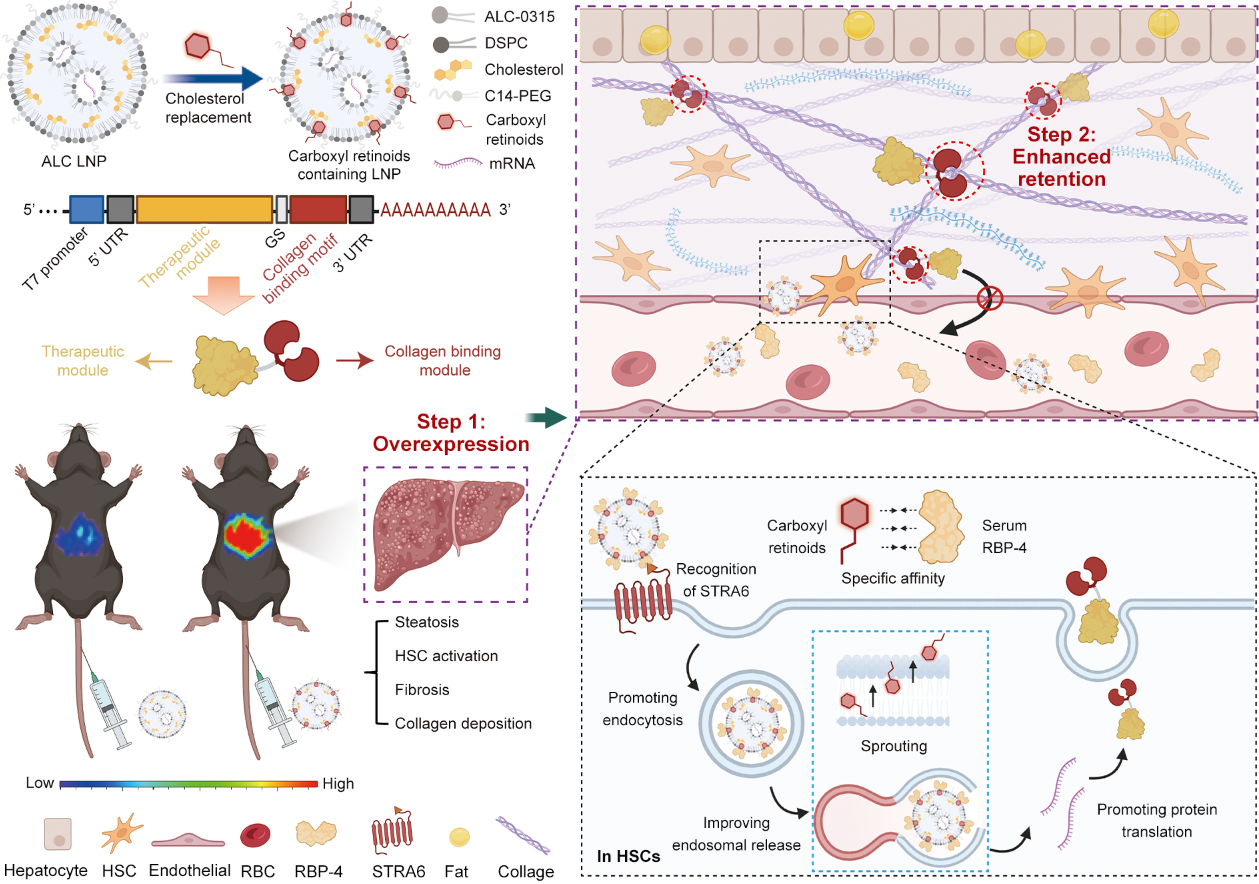
图1. FORT策略示意图(图片来自文章)
研究内容
1. 向LNP 中引入视黄酸提升肝星状细胞( HSC) 及纤维化肝脏 mRNA 的表达
在研究中,作者首先发现多种市售、具有明显肝靶向特征的LNP处方在纤维化肝脏中的mRNA表达均显著降低。随后,作者利用肝星状细胞摄取和储存视黄醇类似物的特性,将四类视黄醇类似物(① 天然视黄醇类;② 天然视黄酸类;③人工修饰的芳香性视黄酸类以及④视黄醇、酸的酯衍生物)引入到LNP处方中。通过细胞水平和疾病模型动物的体内筛选,作者所获得ATRA-LNP处方具有肝星状细胞特异性高表达的特性,其蛋白表达量为传统处方的近10倍(图2)。
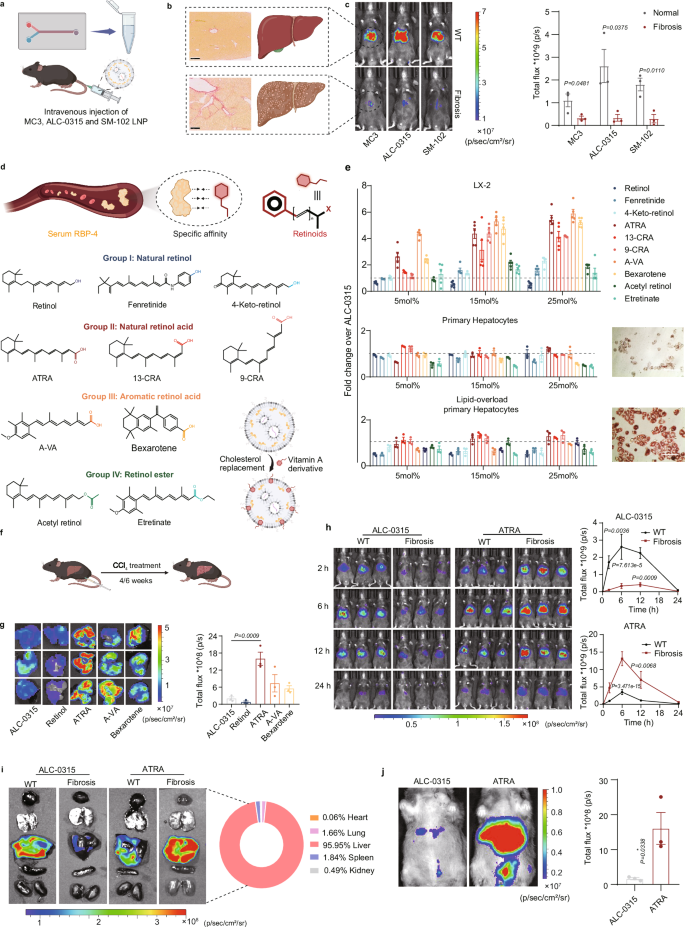
图2. 肝星状细胞特异性高表达LNP的筛选(图片来自文章)
2. ATRA LNP提升表达的机制探究
作者首先证实ATRA LNP提升成纤维细胞而非肝内其他细胞的表达,证明其特异性。随后,作者从成纤维细胞的摄取和内体逃逸两个角度进行机制分析。从细胞摄取的角度,作者发现了以ATRA为代表的羧酸类视黄醇衍生物能够在LNP形成过程中重排于LNP表面,通过视黄醇结合蛋白RBP-4的相互作用增强肝星状细胞的摄取。从内体逃逸的角度,作者分析了实质细胞与成纤维细胞内体膜的组成差异,并利用人工脂质膜证实了ATRA LNP在成纤维细胞内体逃逸中的优势。综合细胞摄取和内体逃逸两方面的优势,作者对ATRA LNP从纳米粒形成到蛋白表达的递送全过程进行了完整解析(图3)。
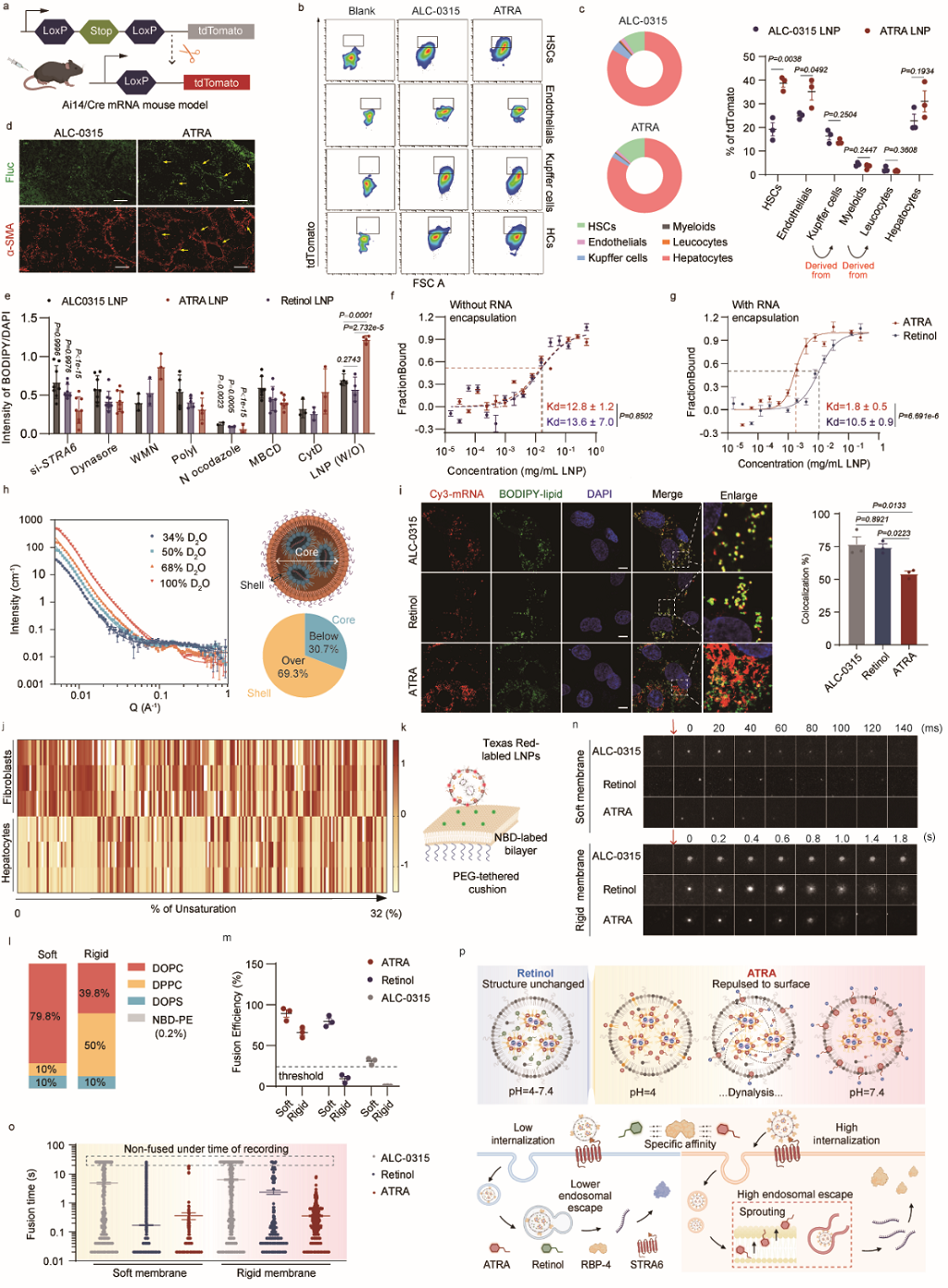
图3. ATRA LNP高表达的机制解析(图片来自文章)
3. 融合蛋白及mRNA的合理设计及验证
作者以抗纤维化多肽药物RLN为模型,通过引入胶原蛋白结合结构域(collagen binding domain,CBD)设计了一系列RLN-CBD融合蛋白,并基于内源性RLN翻译和成熟的规律,设计构建了mRNA序列。随后作者利用前期筛选得到的ATRA LNP实现了RLN-CBD融合蛋白的细胞表达,并胶原结合能力评估,优选得到了RLN-PLGF的融合蛋白(图4)。
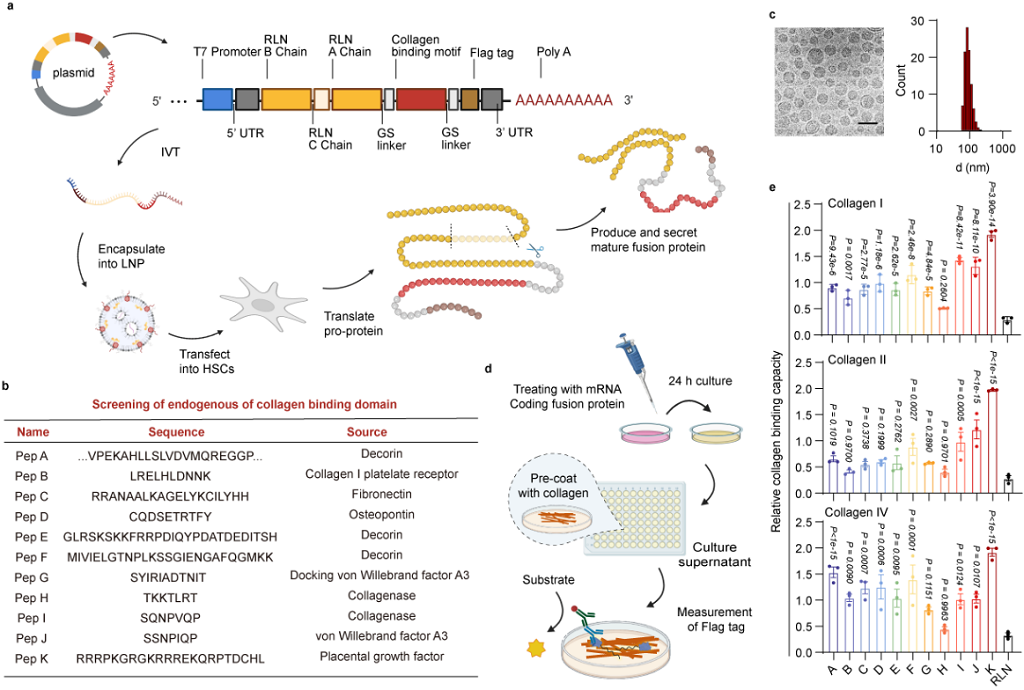
图4. 融合蛋白及mRNA的设计及验证 (图片来自文章)
4. RLN-PLGF融合蛋白的性能以及经ATRA LNP的mRNA递送的体内外效果
作者首先基于PLGF模块的添加比例对融合蛋白的结构进行了优化,并对标专利中报道的Free RLN和RLN-Fc融合蛋白,证实了其胶原结合能力的优势。通过ATRA LNP对mRNA的体内递送,FORT策略的优势得以体现:RLN-PLGF LNP能够显著延长蛋白在纤维化肝脏的滞留时间,相比于RLN-Fc的血液暴露和系统毒性,基于CBD的融合蛋白设计具有明显优势(图5)。
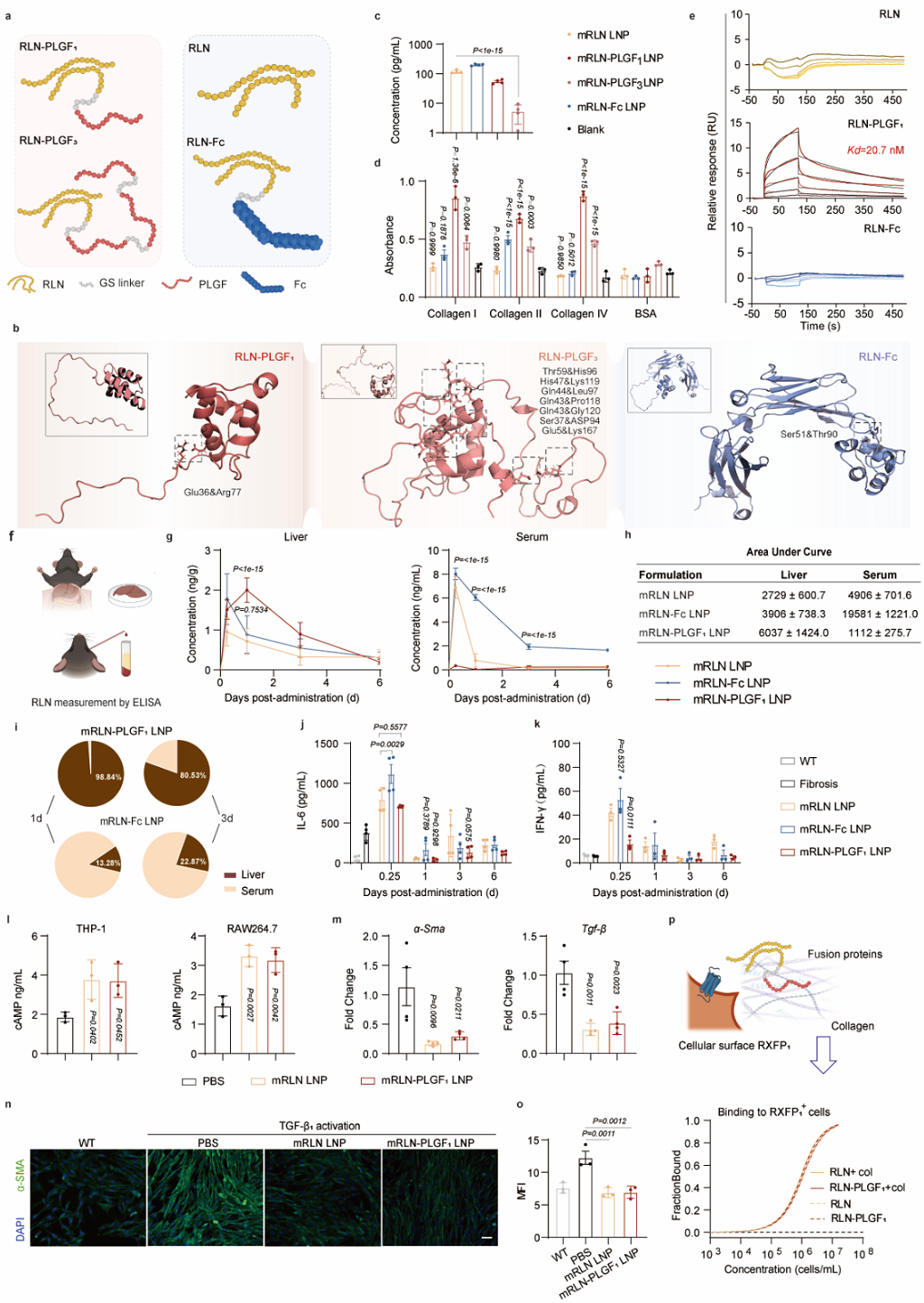
图5. RLN-PLGF ATRA LNP的递送效果(图片来自文章)
5. RLN-PLGF ATRA LNP对MASH疾病模型的治疗效果
基于前期优化得到的ATRA LNP及RLN-PLGF融合蛋白,作者在CCl4诱导的肝纤维化小鼠模型及蛋氨酸胆碱缺乏(MCD)饮食诱导的非酒精性脂肪肝小鼠模型中进行了治疗效果的评估。结果显示,治疗组的肝功能指标(ALT/AST)和纤维化相关指标(α-SNA、天狼星红及马森三色染色等)得到了显著改善,此外,作者也观察到了肝损伤(H&E染色)及肝脏脂肪化(Oil O染色)指标的减轻(图6)。
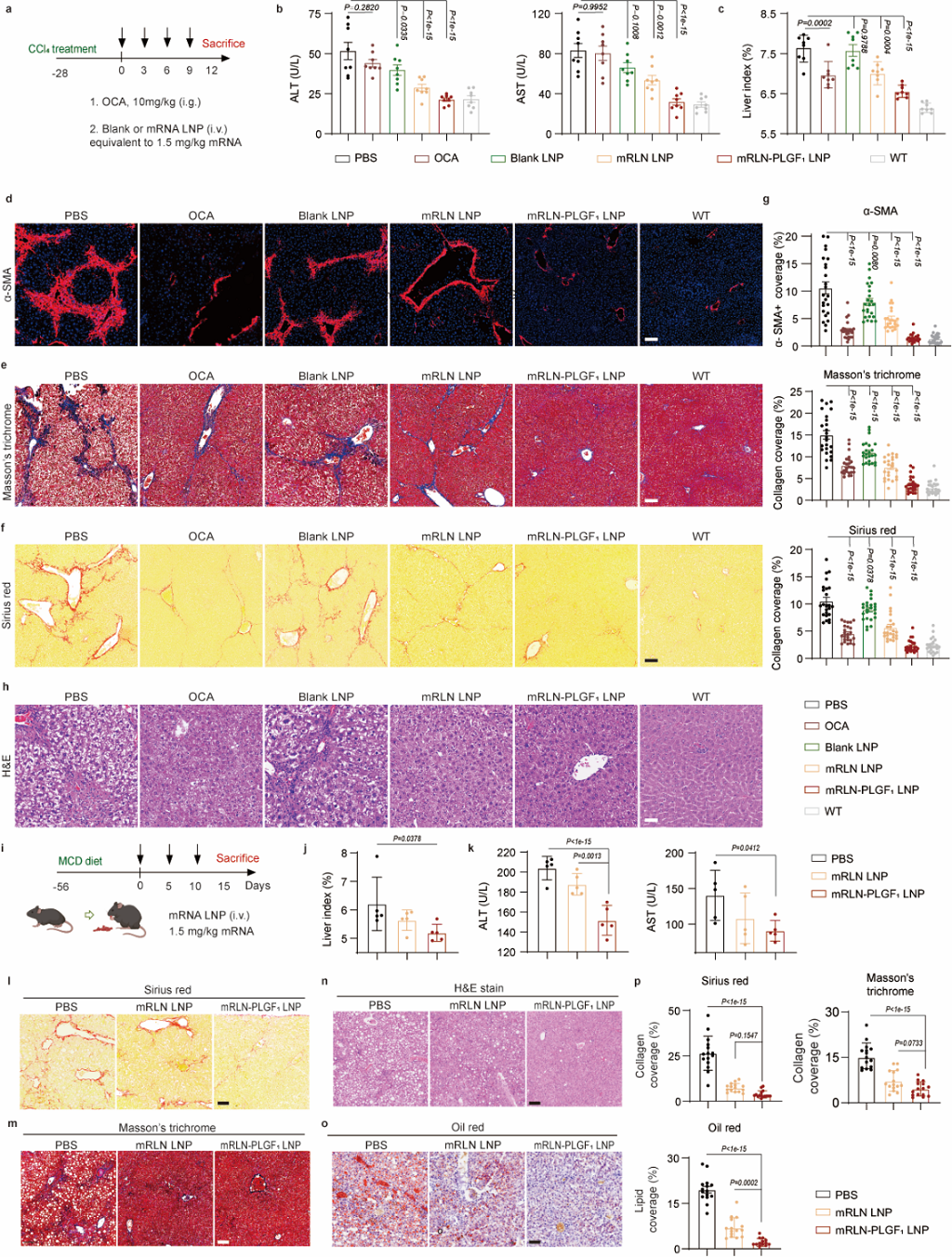
图6. RLN-PLGF ATRA LNP的治疗效果(图片来自文章)
6. 基于FORT策略的开展蛋白替代联合疗法
基于RLN-PLGF ATRA LNP的治疗优势,作者进一步将FORT策略拓展至抗炎蛋白药物IL-10在MASH中的应用。作者首先构建了IL-10-PLGF的融合蛋白,在小鼠肝纤维化模型中得到初步验证后,在胆碱缺乏高脂饮食 (CDHFD)诱导的MASH仓鼠模型上进行了基于RLN-PLGF和IL-10-PLGF LNP的抗纤维化-抗炎联合治疗。作者基于肝脏纤维化、脂质蓄积和验证以及血脂水平进行了全方位的疗效评估(图7)。上述研究结果显示,本研究所开发的FORT策略在MASH的药物递送中实用性强,对于无法原位注射蛋白的脏器纤维化疾病具有良好的应用潜力。
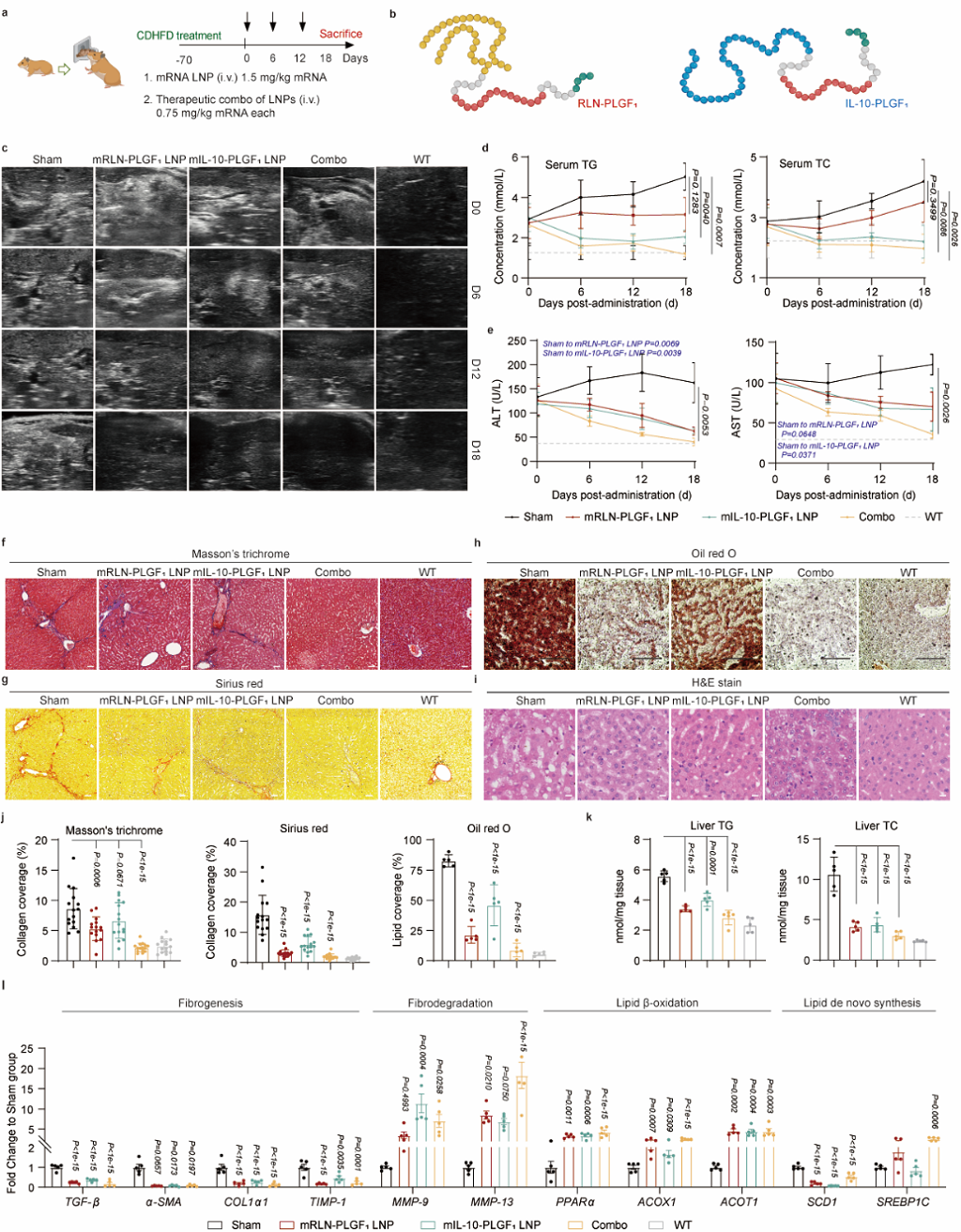
图7. 基于FORT策略的蛋白替代联合疗法(图片来自文章)
总 结
该研究从蛋白的体内表达和病灶滞留两方面出发,构建了一种显著提升局部蛋白药物作用浓度和时间的递送策略。这一成就不仅为MASH 提供高效的治疗方案,同时作为一种设计理念,为多种难以实现蛋白递送的深部脏器疾病的治疗带来希望。
北京大学药学院苗蕾研究员为论文的唯一通讯作者。北京大学药学院博士生单新竹、沈阳药科大学无涯创新学院博士生赵志强为论文的共同第一作者。天然药物及仿生药物全国重点实验室仪器平台李文哲老师和王倩老师、中国散裂中子源柯于斌研究员、中国科学院生物与化学交叉研究中心葛一凡副研究员团队、北京大学心血管研究所冼勋德教授团队、康诺亚生物医药科技有限公司、北京脑科学与类脑研究中心殷杰研究员团队、中国科学院化学研究所吕雪光团队、大连理工大学生物工程学院林佳奇教授团队、沈阳药科大学无涯创新学院罗聪教授团队为该研究做出了重要贡献。该研究得到了国家重点研发计划、国家自然科学基金、北京市科学技术委员会生命科学前沿创新培育项目等基金的支持。
论文链接:https://www.nature.com/articles/s41467-024-51571-8#citeas
作者简介:

单新竹,北京大学药学院2022级博士生,研究兴趣为纤维化相关疾病的靶向与基因治疗。截至目前,已发表SCI论文8篇,累计影响因子93.9。其中第一/共一作者论文5篇,包括Nat Commun,J Controlled Release (2篇),J Nanobiotechnol,Chem Eng J。申请发明专利三项,获批一项。自研究生以来,获国家奖学金两次、其他奖项若干;硕士论文获评辽宁省优秀硕士毕业论文。

赵志强,沈阳药科大学无涯创新学院博士生,研究兴趣为炎症相关疾病的基因疗法。截至目前,以第一/共一作者在Nat Conmmun (2篇), Adv Sci, ACS Nano, Biomaterials, J Controlled Release, Chem Eng J上发表学术论文7篇,累计影响因子超过100。获得辽宁省优秀硕士毕业生及毕业论文,沈阳市优秀研究生等荣誉称号。多次荣获校优秀学生学业奖学金及企业奖学金。

苗蕾,博士,研究员,北京大学博雅青年学者,北京大学药学院药剂系,天然药物及仿生药物全国重点实验室、北京大学-云南白药国际医学研究中心助理教授,国家级人才计划青年项目获得者,并主持北京市自然科学基金重点项目一项。截至目前,在该领域发表SCI论文40余篇,其中第一作者(含共同一作)论文17篇,包括Nat Biotechnol、Nat Commun、Sci Transl Med、Cancer Res、ACS Nano、Adv Funct Mater、Adv Drug Deliv Rev、Mol Cancer、J Controlled Release等,论文SCI引用次数4000余次。研究成果被顶级药学及化学综述期刊等重点介绍。作为发明人之一,授权PCT专利2项,相关知识产权及研究成果已转让于美国知名生物制药企业Translate Bio、初创医药公司OncoTrap和Qualiber用于抗肿瘤疫苗及肿瘤微环境调节剂的研究与开发。
天然药物及仿生药物全国重点实验室 供稿