
-

生物通官微
陪你抓住生命科技
跳动的脉搏
我国学者与海外合作者在卵巢癌免疫治疗新靶点研究方面取得进展
【字体: 大 中 小 】 时间:2024年08月01日 来源:国家自然科学基金委员会
编辑推荐:
图 新辅助化疗或PARP抑制剂重塑HRD肿瘤免疫微环境的机制 在国家自然科学基金项目(批准号:82372928、82373332、82272707、82072889、81974405、81772787)等资助下,华中科技大学高庆蕾教授、方勇教授和马丁教授团队联合美国M.D. Anderson癌症中心梁晗教授团队在卵巢癌免疫治疗方面取得进展,研究结果以“卵巢癌新辅助PARPi或化疗揭示eTreg细胞为HRD肿瘤新靶点(Neoadjuvant PARPi or Chemotherapy in Ovarian Cancer Informs Targeting Effector Treg Cells for Homologous-Recombination-Deficient Tumors)”为题,于2024年7月5日在《细胞》(Cell)杂志上在线发表
| |
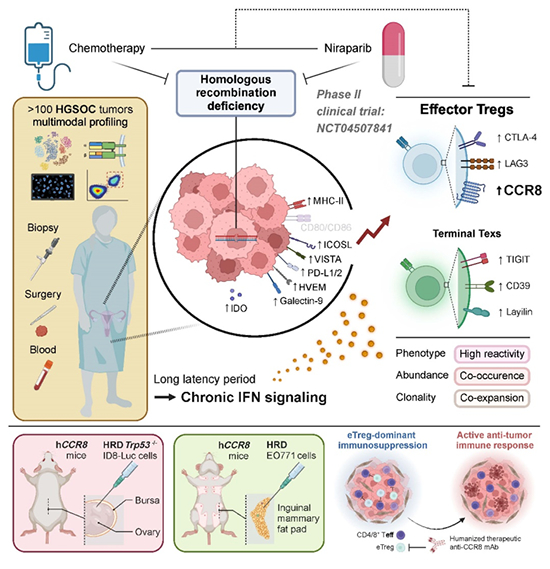 |
图 新辅助化疗或PARP抑制剂重塑HRD肿瘤免疫微环境的机制
在国家自然科学基金项目(批准号:82372928、82373332、82272707、82072889、81974405、81772787)等资助下,华中科技大学高庆蕾教授、方勇教授和马丁教授团队联合美国M.D. Anderson癌症中心梁晗教授团队在卵巢癌免疫治疗方面取得进展,研究结果以“卵巢癌新辅助PARPi或化疗揭示eTreg细胞为HRD肿瘤新靶点(Neoadjuvant PARPi or Chemotherapy in Ovarian Cancer Informs Targeting Effector Treg Cells for Homologous-Recombination-Deficient Tumors)”为题,于2024年7月5日在《细胞》(Cell)杂志上在线发表。论文链接:https://doi.org/10.1016/j.cell.2024.06.013。
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,其中高级别浆液性卵巢癌(High-grade serous ovarian cancer, HGSOC)占比最高(占比70%)、恶性程度也最高。目前标准的治疗方案仍为铂类药物为主的新辅助化疗,虽然患者早期响应率较高,但容易发生耐药,五年生存率仅30%。同源重组修复缺陷(Homologous recombination deficiency, HRD)在卵巢癌中存在较为普遍,与肿瘤细胞对PARP抑制剂(PARPi)的敏感性增加有关。然而,HRD及其相关治疗对肿瘤微环境(Tumor microenvironment, TME)的影响尚不明确。
基于一项前瞻性临床试验(NANT, NCT04507841),该团队利用单细胞基因表达和T细胞受体分析发现:HGSOC中效应调节性T细胞(effector regulatory T cells, eTregs)是HRD和新辅助疗法的关键响应者,并与其他肿瘤反应性T细胞,特别是终末耗竭型CD8+ T细胞(Tex)共同存在。TME中的干扰素信号参与上调癌细胞表面MHC II类分子和其他共抑制分子,进而驱动Treg和Tex的命运。在HRD-HGSOC小鼠模型中,无论是否使用PARP抑制剂,eTregs的耗竭都能显著抑制肿瘤生长,且未观察到明显的毒性,这突出了针对eTregs的治疗策略在HGSOC和其他HRD相关肿瘤中的潜力。进一步研究发现应用CCR8单抗或CD25单抗靶向清除eTreg并联合尼拉帕利治疗HRD类型HGSOC,可取得更加显著抑瘤效果(图)。
该研究从临床问题出发,解析了PARP抑制剂和含铂类化疗药物重塑HRD-HGSOC免疫微环境的机制,并发现HRD肿瘤的免疫治疗新靶点eTreg,为HRD肿瘤免疫治疗提供了新思路。