
-

生物通官微
陪你抓住生命科技
跳动的脉搏
星形胶质细胞亚群与神经系统疾病
【字体: 大 中 小 】 时间:2024年07月24日 来源:凯杰生命科学
编辑推荐:
小编将通过两篇Nature文章,带您学习顶刊如何设计实验和解读组学数据。
星形胶质细胞是中枢神经系统中的重要组成部分,它们数量众多并且功能复杂,在维持和保护神经网络中扮演重要角色。之前的研究表明,大脑不同区域的星形胶质细胞在转录水平和功能上具有高度异质性,但尚不清楚这种异质性的来源和意义。星形胶质细胞的激活状态与多发性硬化症、阿尔兹海默症、帕金森病、亨廷顿病等多种神经疾病相关,但目前我们对神经系统疾病的认知依然不够,诊治的方法也有限。行为学实验、分子生物学实验以及组学数据的整合,拓展了神经疾病的研究策略,能够将细胞亚群与疾病进行关联研究,为疾病诊治提供新靶点和思路。

Nature | ACLY+EP300+星形胶质细胞的免疫记忆促进神经系统疾病发展
免疫记忆是指细胞受到同一抗原的再次刺激时,产生比第一次更强的免疫反应,通常由T细胞和B细胞行使这一功能。近期的研究表明,某些其他类型的细胞在经历抗原反复刺激时,转录、表观遗传修饰和代谢水平也会发生改变,产生疾病相关的炎症因子。然而,在神经疾病中,目前尚不清楚星形胶质细胞是否对反复抗原刺激做出改变。今年3月,哈佛医学院的研究人员在Nature杂志上发表论文[1],系统研究了星形胶质细胞免疫记忆与神经系统疾病的关系。
首先,为了研究反复刺激是否会影响星形胶质细胞,研究人员对小鼠进行了一周一次或两次的IL-1β和TNF注射,检测一次和两次注射后星形胶质细胞的转录水平差异。然后通过生物意义挖掘软件Ingenuity Pathway Analysis(IPA),发现两次注射激活了神经炎症、急性响应、趋化因子等信号通路(图1A),提示两次注射比一次注射产生了更强的促炎反应。同时,采用IPA发现NF-κB和EP300是两次注射后被显著激活的上游调控因子,组蛋白去乙酰化酶HDAC4和HDAC5是被显著抑制的上游调控因子(图1B)。同时,在多发性硬化症的小鼠实验模型EAE中,H3K27ac+EP300+星形胶质细胞数量显著增加(图1C),提示EP300和组蛋白乙酰化可能调控星形胶质细胞的免疫记忆,促进疾病发展。
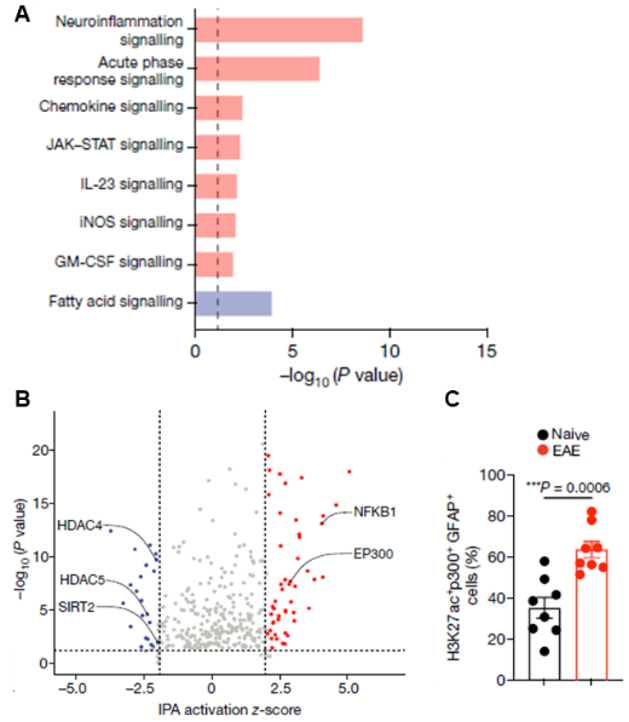
图1.(A)两次注射后差异表达基因富集的信号通路,红色表示激活,蓝色表示抑制。(B)调控两次注射后基因差异表达的上游调控因子,红色表示激活,蓝色表示抑制。(C)正常和EAE模型小鼠中,H3K27ac+EP300+星形胶质细胞比例。
为了研究神经疾病中,EP300在星形胶质细胞中的功能,研究人员构建了EP300敲除的EAE小鼠。通过比较敲除前后星形胶质细胞的转录组和ChIP-seq数据,发现EP300敲除降低了H3K27乙酰化(图2A),并且与组蛋白结合减少的基因与蛋白翻译后修饰、转录和代谢相关(图2B),表明EP300改变了星形胶质细胞的表观遗传记忆。
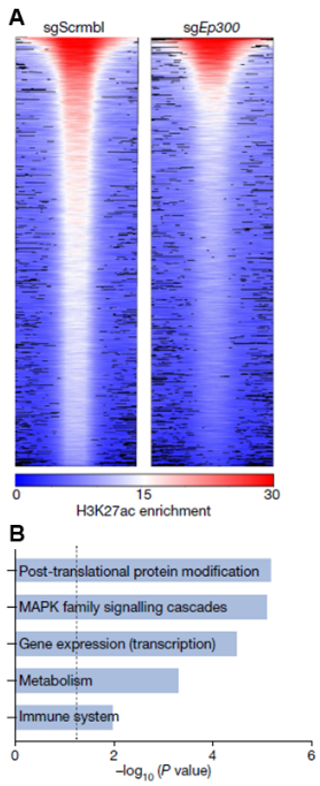
图2.(A)小鼠EAE模型中,EP300敲除与未敲除状态下,H3K27乙酰化富集程度。(B)组蛋白结合减少的基因富集的信号通路。
ACLY和ACSS2是哺乳动物中常见的两个蛋白乙酰化酶,在两次注射后的星形胶质细胞中,只有ACLY表达量提高。在EAE模型中,ACLY+EP300+的星形胶质细胞比例更高(图3A)。进一步,为了探究星形胶质细胞表观遗传记忆的乙酰化酶,研究人员构建了ACLY敲除的EAE小鼠。采用IPA,发现ACLY敲除后下调的基因富集在急性响应、神经炎症、趋化因子等信号通路(图3B),提示ACLY失活减轻了炎症反应。IPA还鉴定出ACLY敲除后,EP300和NF-κB处于抑制状态(图3C),逆转了炎症,这些结果表明ACLY驱动了EP300介导的表观记忆。
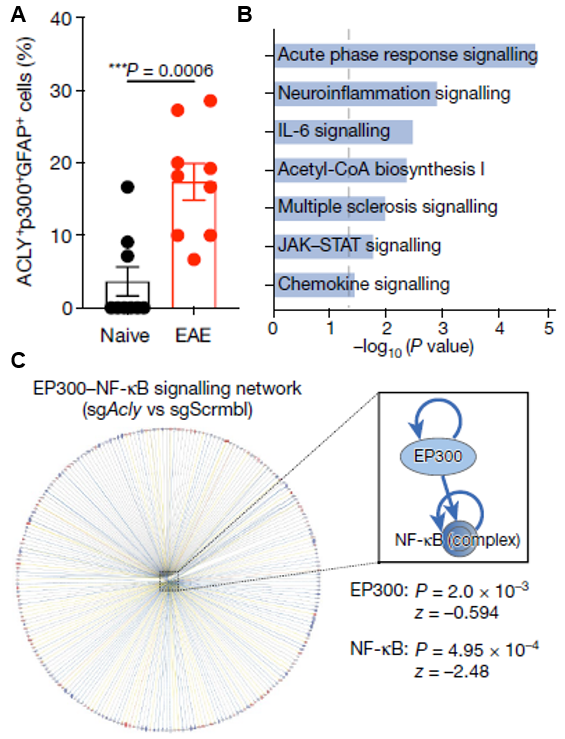
图3.(A)正常和EAE模型小鼠中,ACLY+EP300+星形胶质细胞比例。(B)ACLY敲除后,下调基因富集的信号通路。(C)ACLY敲除后,EP300和NF-κB是被抑制的上游调控因子。
至此,研究人员发现了ACLY+EP300+星形胶质细胞亚群激活了细胞炎症响应,恶化了神经疾病。由于ACLY和EP300分别定位在细胞质和细胞核中,无法通过传统方式将其筛选出来。研究人员借助FIND-seq技术,发现EAE模型中ACLY和EP300共表达的星形胶质细胞数量增加(图4A),并且显著表达表观遗传记忆相关的基因(图4B)。
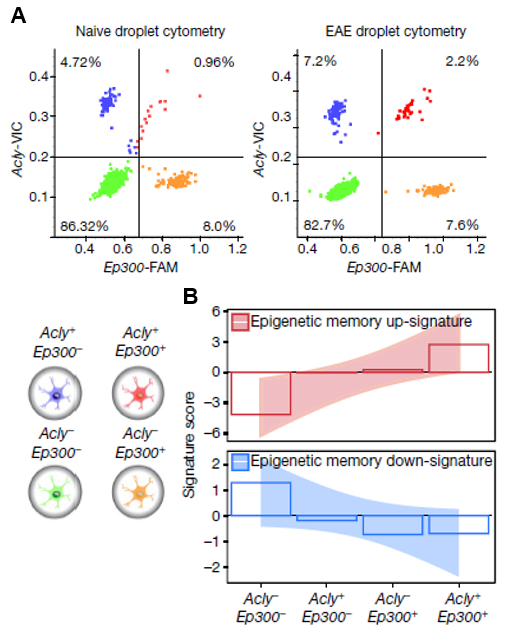
图4.(A)通过FIND-seq技术,筛选小鼠EAE模型中ACLY和EP300不同表达水平的星形胶质细胞。(B)表观遗传记忆相关基因在ACLY和EP300不同表达水平的星形胶质细胞中的表达情况。
通过公共数据挖掘,研究人员重新分析了小鼠EAE模型星形胶质细胞的scRNA-seq(图5A),也发现了ACLY和EP300共表达的细胞群(图5B)。采用IPA,研究人员发现这群细胞激活了神经炎症、急性响应、趋化因子等信号通路(图5C),也激活了ACLY、EP300和NF-κB等上游调控因子(图5D)。
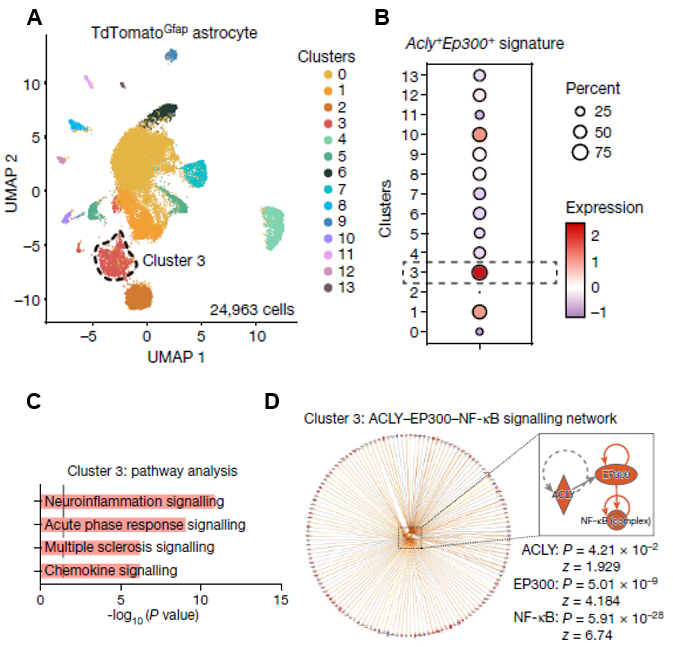
图5.(A)小鼠EAE模型星形胶质细胞scRNA-seq的UMAP图。(B)ACLY和EP300共表达细胞的基因表达水平在不同细胞群的相似度。(C)细胞群3激活的信号通路。(D)细胞群3激活的上游调控因子及其调控的基因。
不仅在小鼠EAE模型中,研究人员也重新分析了多发性硬化症患者星形胶质细胞的scRNA-seq(图6A),同样发现了ACLY和EP300共表达的细胞群(图6B)。通过IPA,研究人员发现患者体内的ACLY和EP300共表达的星形胶质细胞也激活了趋化因子、神经炎症、急性响应等信号通路(图6C),同样激活了ACLY、EP300和NF-κB等上游调控因子(图6D)。
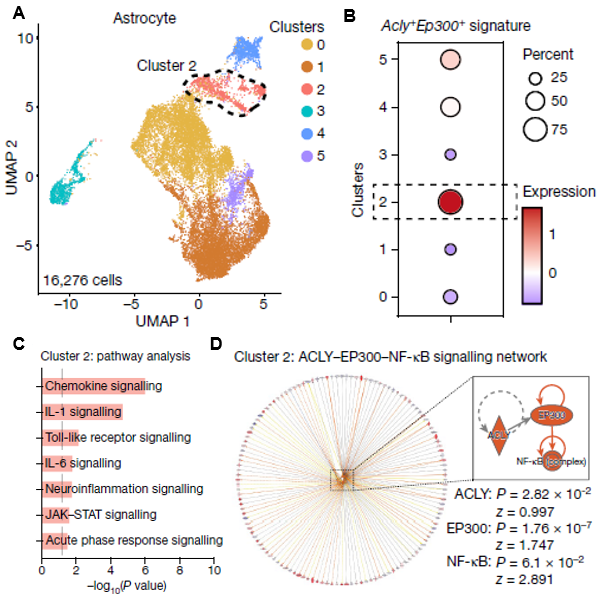
图6.(A)多发性硬化症患者星形胶质细胞scRNA-seq的UMAP图(B)ACLY和EP300共表达细胞的基因表达水平在不同细胞群的相似度。(C)细胞群2激活的信号通路。(D)细胞群2激活的上游调控因子及其调控的基因。
该研究通过两次IL-1β和TNF注射发现星形胶质细胞也具有免疫记忆,通过敲除小鼠、免疫荧光、RNA-seq、ChIP-seq、FIND-seq等技术,揭示了ACLY+EP300+星形胶质细胞亚群通过表观遗传记忆影响神经系统疾病。通过公共数据挖掘,进一步证实了该现象的普遍性,阐述了ACLY、EP300和NF-κB在神经炎症中的重要性,为神经疾病的治疗提供了新思路。

Nature | 纹状体Crym+星形胶质细胞调控刻板行为
星形胶质细胞是神经回路的重要成员,它们在大脑各区域表现出多样性,可能与特定的神经回路关联。但目前尚不清楚特定星形胶质细胞亚群与神经回路的联系,以及它们对生理、行为和疾病的影响。今年2月,加州大学洛杉矶分校的研究人员在Nature杂志发表论文[2],表明纹状体Crym+星形胶质细胞亚群与刻板行为相关。
首先,通过公共数据挖掘,研究人员发现纹状体中的星形胶质细胞高表达Crym。同时,Crym表达水平在强迫症和亨廷顿病患者中显著下降(图7A)。然而,目前对于Crym+星形胶质细胞知之甚少。接着,为了研究Crym基因,研究人员向纹状体中心注射了Crym基因的sgRNA,构建了纹状体Crym敲低的小鼠。进一步,通过多种行为学实验,研究人员发现Crym 敲低小鼠在大理石掩埋试验中埋藏更多大理石(图7B),并且花费更多时间理毛(图7C),提示Crym敲低小鼠表现出刻板行为模式。通过电生理学实验,研究人员发现Crym缺失影响了侧眶额叶皮层与纹状体间的通信,减弱了突触前抑制,增强了兴奋性传递(图7D)。进一步,研究人员借助化学遗传学工具DREADD技术,恢复了突触前抑制功能,小鼠的刻板行为得到改善(图7E)。
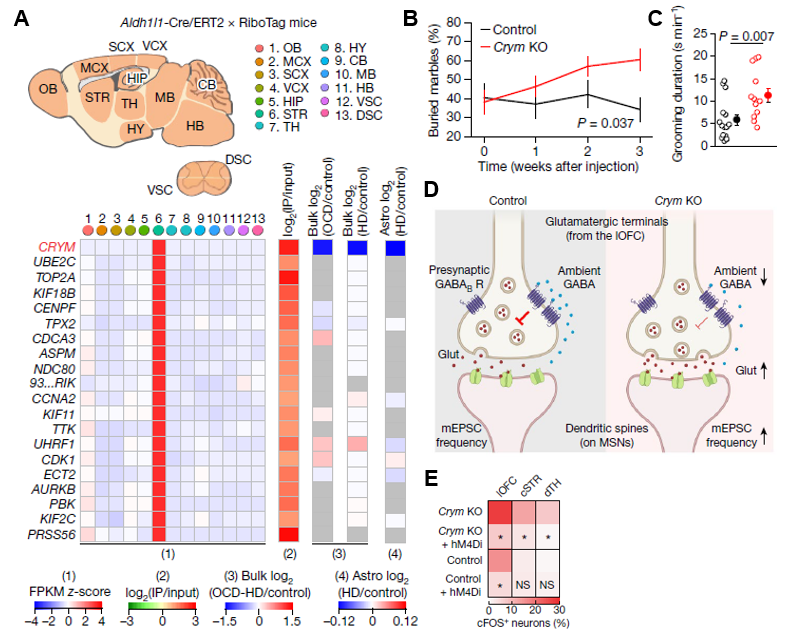
图7.(A)Crym在多个公共数据中的表达水平。(B)未敲低和敲低Crym,小鼠埋藏的大理石数量。(C)未敲低和敲低Crym,小鼠理毛花费的时间。(D)未敲低和敲低Crym,侧眶额叶皮层与纹状体间突触结构和神经回路的示意图。(E)通过DREADD技术恢复突触前抑制, 不同脑区的cFOS+神经元比例。
以上研究借助多种实验,表明纹状体Crym+星形胶质细胞通过突触前抑制调控异常行为。接着,研究人员比较了Crym+和Crym-星形胶质细胞在转录水平上的差异。在星形胶质细胞标记物基因方面,两类细胞的表达水平相似(图8A),并且仅有178个显著差异表达基因(图8B)。采用IPA,研究人员将Crym+星形胶质细胞特有基因和共有基因分别做富集分析,发现Crym+星形胶质细胞激活平面细胞极性、翻译后磷酸化修饰和胰岛素生长因子等信号通路,抑制髓鞘和突触形成等信号通路(图8C),表明Crym+星形胶质细胞呈现出独特的功能性。
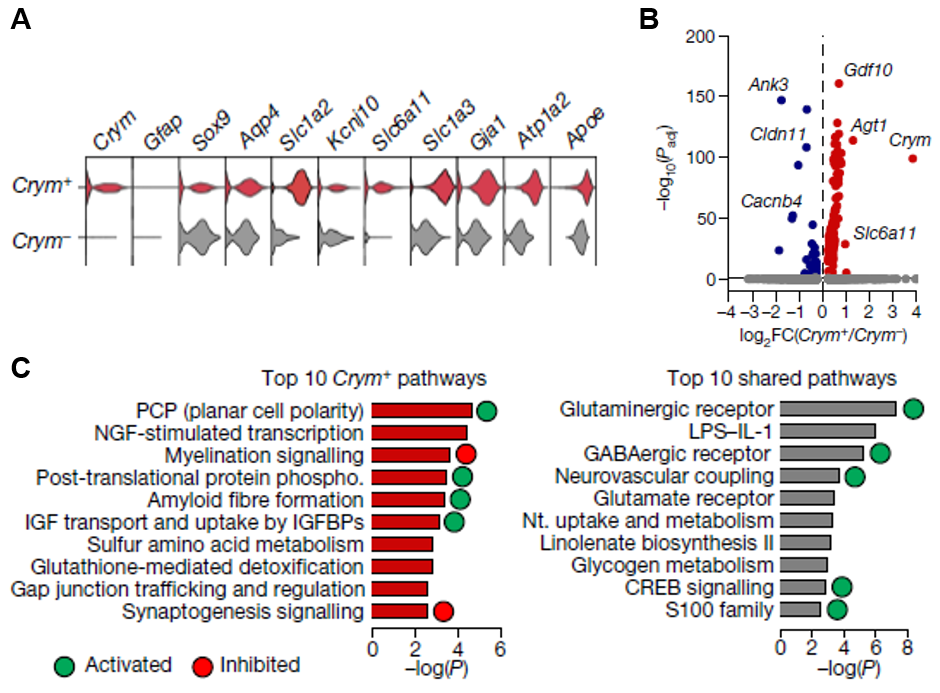
图8.(A)星形胶质细胞标记物基因在Crym+和Crym-细胞中的表达水平。(B)Crym+和Crym-星形胶质细胞转录水平的火山图。红色表示上调,蓝色表示下调。(C)Crym+星形胶质细胞独有基因和共有基因显著富集的前10个信号通路。
该研究通过公共数据挖掘、敲除小鼠、行为学实验、电生理实验、化学遗传学实验和RNA-seq等技术,详细阐述了纹状体Crym+星形胶质细胞调节刻板行为的机制,强调了CRYM蛋白在调控神经递质释放的作用,为神经疾病的治疗提供了新靶点。
以上两篇文章整合了多种生物学实验和组学数据,详细研究了特定星形胶质细胞亚群与神经疾病的关系。组学数据不仅能够解释实验现象,也能够为后续实验提供指导,因此全面深入地解读组学数据十分关键。Ingenuity Pathway Analysis(IPA)汇集了海量文献,人工整理得到分子间的调控关系,从生物学通路、上游调控因子、下游疾病和功能、调控网络、调控模式相似或相反的公共数据等诸多方面系统解读组学数据,助力疾病研究、靶点挖掘、解析药理毒理等。为了更好地帮助大家解读组学数据,我们推出了全新的IPA学习平台,欢迎扫描下面的二维码,获取最新的视频资料。


参考文献
Disease-associated astrocyte epigenetic memory promotes CNS pathology, Nature, 2024 Mar;627(8005):865-872.
Crym-positive striatal astrocytes gate perseverative behaviour, Nature, 2024 Mar;627(8003):358-366.