
-

生物通官微
陪你抓住生命科技
跳动的脉搏
干货 | WB常用显影方法原理和优劣势对比
【字体: 大 中 小 】 时间:2024年07月17日 来源:易孛特生命科学
Western blot也称蛋白免疫印迹,是一项利用聚丙烯酰胺凝胶电泳和抗原抗体特异性结合来检测特定样品或提取物中靶标蛋白的方法。
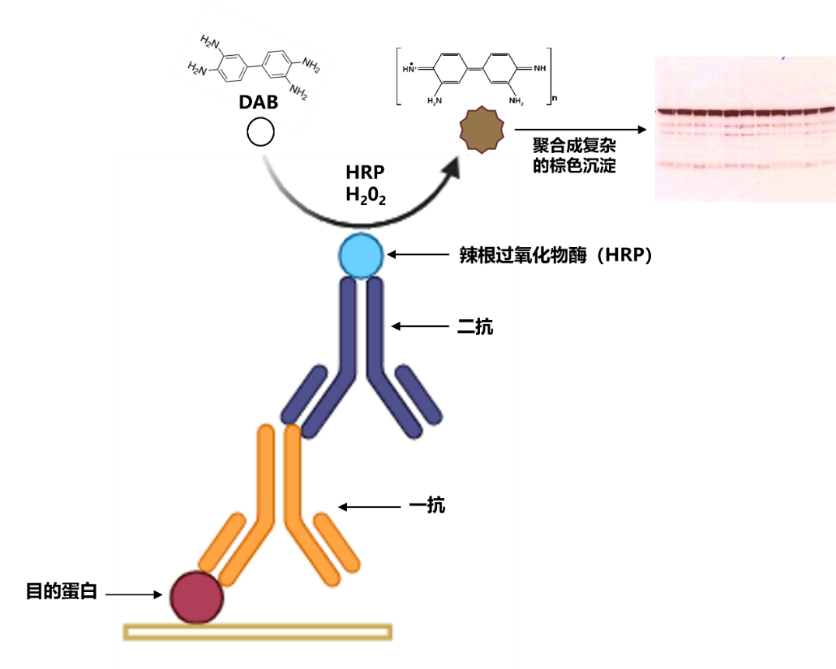
原理:不同分子量的蛋白质经过SDS-PAGE凝胶电泳分离开后,转移到固相膜(如PVDF膜和NC膜)上,以固相膜上的靶标蛋白做为抗原,首先加入与靶标蛋白可发生特异性结合的一抗,再加入与一抗特异性反应的二抗,最后根据二抗的标记选择合适的方法检测靶标蛋白,以实现靶标蛋白的定性和半定量分析 。
显影方法的选择是要根据二抗的标记,二抗可以通过多种方式进行标记,目前最常见的是将酶偶联至二抗,比如辣根过氧化物酶(HRP)或碱性磷酸酶(AP),其次是荧光素偶联至二抗。基于这几种标记,常用的显影方法有直接显色法、化学发光法和荧光法。那么在这里我们先逐一梳理一下这几种方法的显影原理和优劣势。
一. 直接显色法
直接显色法也常被成为第一代Western blot显影技术,其反应原理是加入相应生色底物后,经过抗体偶联的酶进行催化反应,生成有色沉淀物,当沉淀物在印迹膜上积累时,会产生肉眼可见的条带信号,可以拍照。
1. 辣根过氧化物酶(HRP)标记系统:辣根过氧化物酶(HRP)因比活高、分子量小、特异性强、稳定性好和作用底物范围广且经济的优点而成为广泛使用的交联酶。辣根过氧化物酶(HRP)最常见的生色底物有以下几种:
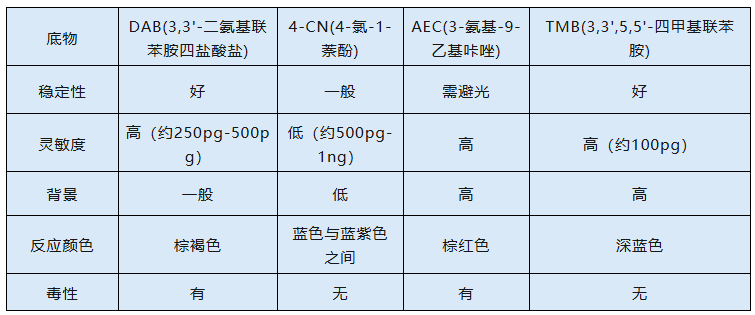
其中DAB是辣根过氧化物酶(HRP)的常用底物,DAB在有辣根过氧化物酶(HRP)和过氧化氢(H2O2)的存在下失去电子生成棕褐色沉淀产物:
2. 碱性磷酸酶(AP)标记系统:可兼容碱性磷酸酶(AP)的生色底物有以下几种:
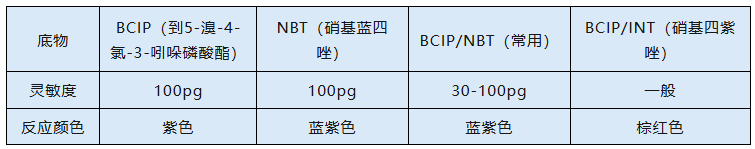
其中BCIP/NBT因其灵敏度最高、成像性能好成为碱性磷酸酶最常用的生色底物组合。碱性磷酸酶(AP)通过去磷酸化催化溴氯吲哚基中间体的形成。NBT氧化吲哚氧基,产生紫色沉淀,然后NBT被还原成不溶的蓝色二甲沉淀物。两种沉淀物的组合累积在印迹膜上目标蛋白质所在之处,形成肉眼可见的紫蓝色沉淀。
直接显色法虽然操作简单,直接在印迹膜上均匀滴加显色底物,反应后可在印迹膜上直接看到信号条带,不需要成像设备,成本相对较低。但是直接显色法灵敏度低,低丰度蛋白无法检测,并且定量范围窄,只有1.5OD,表达差异大的蛋白无法准确定量,限制了其在Western blot上的应用。
二. 化学发光法
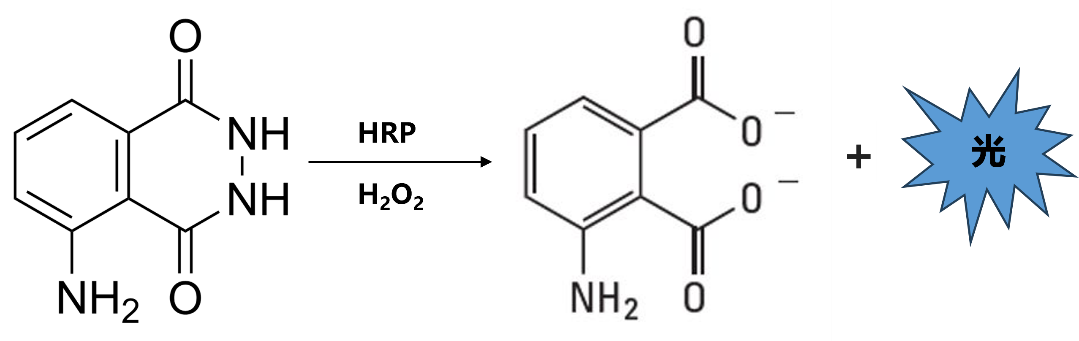
辣根过氧化物酶(HRP)-鲁米诺系统:在过氧化氢(H2O2)和辣根过氧化物酶(HRP)存在下,鲁米诺被氧化成3-氨基邻苯二甲酸酯的激发产物,这种产物通过释放光子衰减到较低能量的状态,在425nm有发射光。所发出的光可用化学发光成像仪或X光胶片来捕获。反应式如下:
碱性磷酸酶(AP)- CDP-Star系统:碱性磷酸酶(AP)将CDP-Star去磷酸化,得到亚稳定的二恶茂烷酚盐阴离子,该中间体分解并发出最大强度的光,波长在466 nm。所发出的光可用化学发光成像仪或X光胶片来捕获。反应式如下:
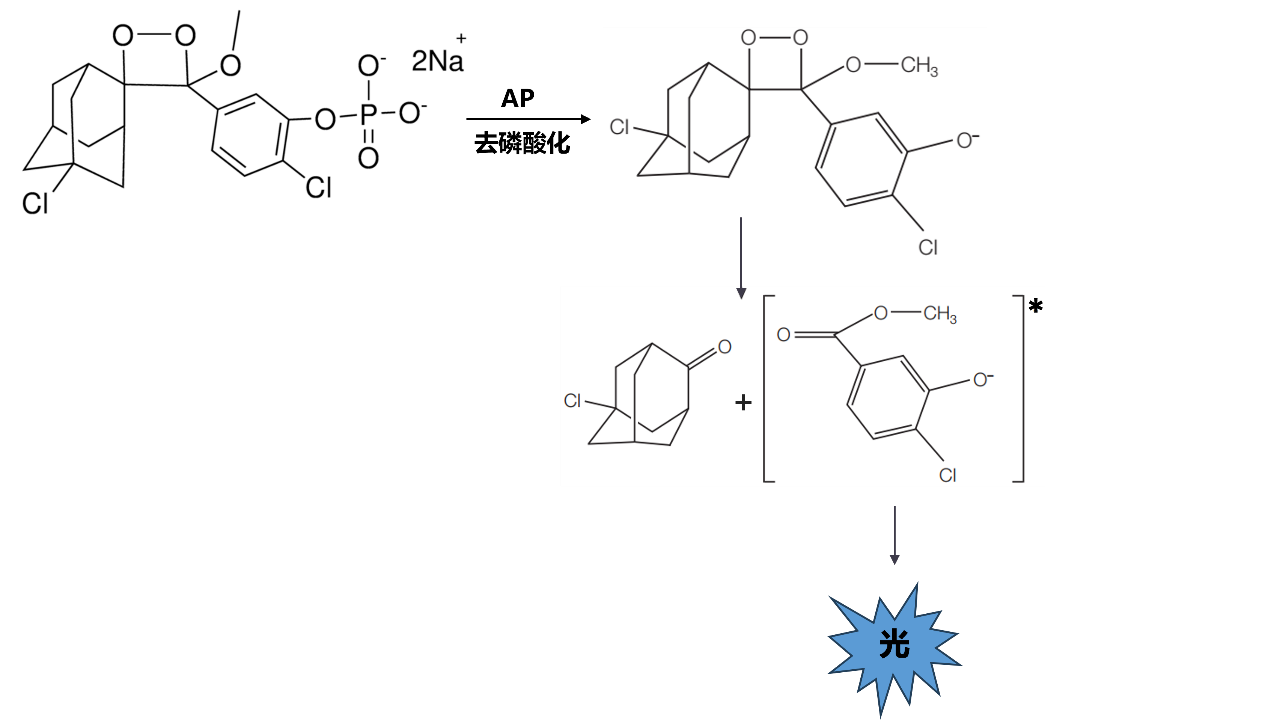
化学发光检测方法包括曝光X光胶片和化学发光成像仪成像。曝光X光胶片即传统的暗室压片方法,也常被称为第二代Western blot显影技术,其成像原理是胶片直接跟印迹膜贴合,利用压片暗盒进行压片,在压片的过程中X胶片会吸收光信号,光与其中的银盐晶体发生化学反应生成银离子,紧接着将胶片置于显影液中,显影液中的化学物质将其中的银离子还原成黑色的银颗粒,形成可见的黑白图像。最后,将胶片置于定影液中,将未被还原成银颗粒的银盐晶体洗去,保留下来的图像就是最终的成像效果。暗室压片的优势在于灵敏度很高,因为X胶片跟膜是贴合的,没有任何光信号的损失,并且图像真实,这两者也是部分实验室仍然保留暗室压片方法的主要原因。但是由于胶片中感光晶体对光信号的承载量有限,所以暗室压片的定量范围比较窄,强信号比较容易过曝,无法准确定量,此外由于X胶片对光很敏感,所以整个曝光显影过程要在单独的暗室中进行,除了需要胶片、显影液、定影液这些耗材之外,整个过程操作也比较繁琐。

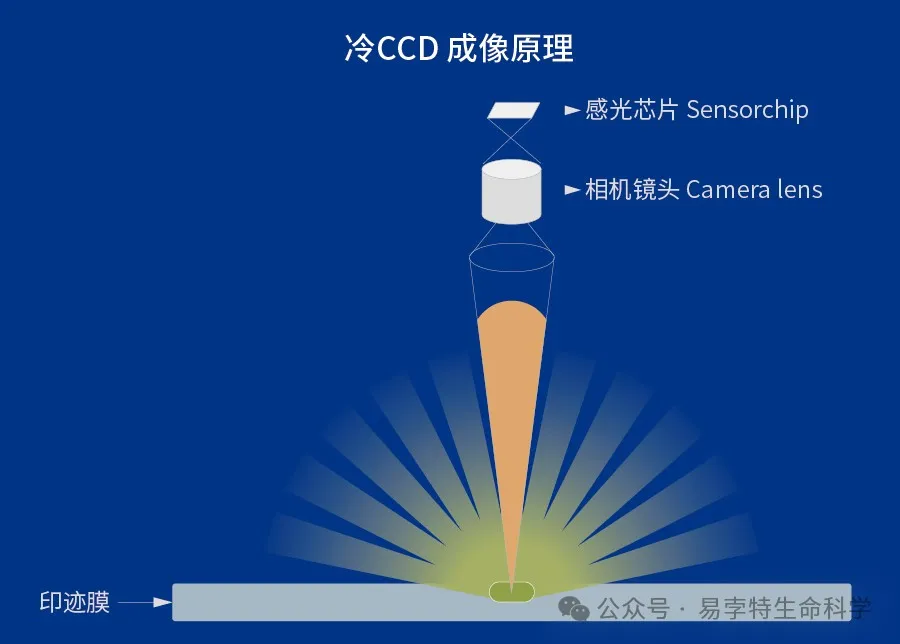
第三代Western blot显影技术——冷CCD成像的出现弥补了传统暗室压片的缺点,冷CCD的成像原理是利用CCD (电荷耦合器件,charge-coupled device )将光信号转化成电信号,并通过电信号的不同来表示光信号的不同。其定量范围相较于传统暗室压片有提升,理论上可以达到 4.8OD,但是实际在3OD,部分表达量差异大的蛋白可以准确定量 ,并且不需要单独的暗室,也不需要显影液、定影液这些耗材,操作更加简便。但是冷CCD成像的灵敏度相较于传统暗室压片是降低的,一些微弱信号无法采集到,原因如下:
1. Western blot 膜离CCD芯片距离太远,导致绝大部分的光信号传输过程中直接损失掉了,并未到达CCD感光芯片;
2. 冷CCD成像仪器所用的芯片大多只有1英寸或者更小,信号获取的能力远远不够;
3. 冷CCD成像需要前面加一个镜头才能实现成像,镜头内部都有一系列的透镜组,这些透镜组除了会导致图像几何畸变,图像弥散之外,也会将本就非常微弱的化学发光信号阻挡掉一大半;
4. 冷CCD成像所需成像时间太长,CCD本身的噪音随着时间的延长会积累,弱信号会被这些噪音所掩盖掉以至于不能成像。
其次冷CCD成像定量范围虽然较压片法有提升,但仍然无法满足现在科研的需求,主要是因为冷CCD成像仪器成像芯片本身的单个像素尺寸太小,边长一般在3-6um之间,像素太小导致芯片本身储存信号的能力太弱,信号极易过度曝光,强弱信号无法同时呈现,进而无法准确定量。最后冷CCD成像设备需要提前遇冷,维护成本比较高。
面对科研越来越卷的今天,基于传统暗室压片和冷CCD成像的技术局限,我们迎来了第四代Western blot显影技术——e-BLOT接触式电子压片成像技术,全球首次革命性的将接触式成像方式应用到Western blot化学发光成像领域,实现了Western blot显影技术质的飞跃,将Western blot成像带入一个全新的时代。
1. 首先其灵敏度比冷CCD 高2个数量级:
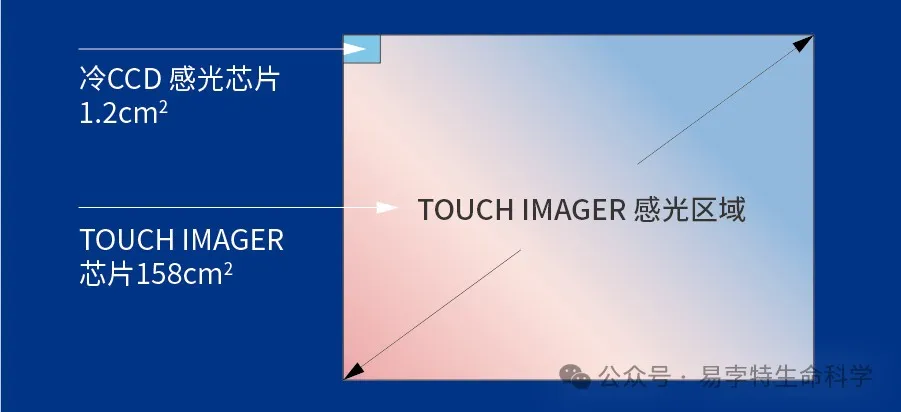
① 成像芯片的面积是冷CCD成像芯片面积的137倍,Western膜直接贴在感光芯片上进行成像,超大的感光芯片具有超高的信号采集能力,所有信号均被采集,没有任何光损失,极大的提高了成像的灵敏度;

② 单个像素尺寸是冷CCD成像单个像素尺寸面积的493倍,灵敏度跟单个像素点尺寸是成正比的,单个像素点尺寸越大,灵敏度越高。
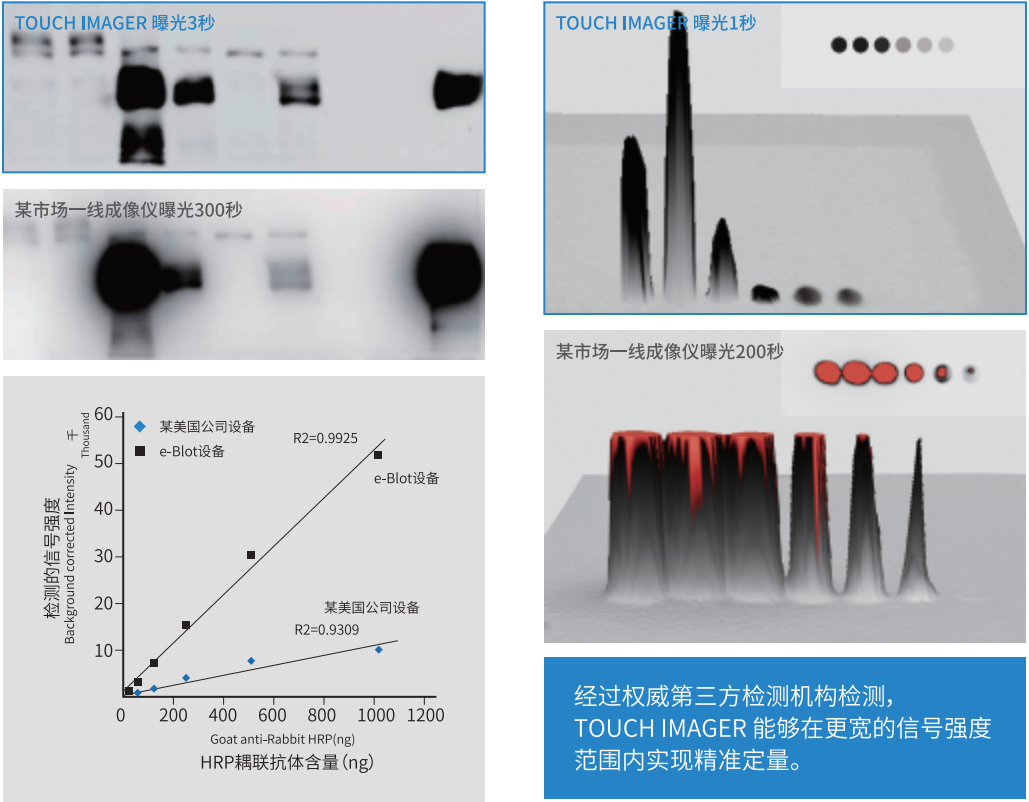
2. 其次是定量范围比冷CCD 高2个数量级:
定量范围也是跟单个像素尺寸大小有关,单个像素尺寸越大,所能容纳的满井电子数越多,定量范围也就越宽,e-BLOT接触式电子压片单个像素点的尺寸是冷CCD成像单个像素尺寸面积的493倍,也是其定量范围高2个数量级的主要原因。
3. 最后是其成像速度超快,体积小。
① >95%的样品可以1秒成像,
② 同时实验室空间可以节省90%,,只有A4纸大小。
e-BLOT接触式电子压片成像凭其优良的性能得到客户的高度评价:原来拍不出来的,现在可以了!

三. 荧光法
蛋白印迹上的目标蛋白质也可以使用与荧光染料标记的一级或二级抗体进行检测。染料以特定波长发荧光,通过荧光成像设备进行检测。
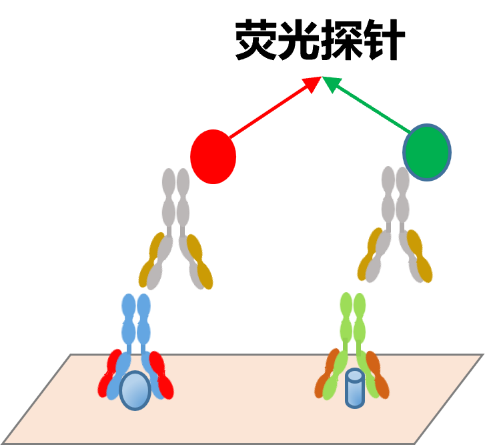
荧光法的好处是可以在同一张膜上获得多重数据,但是荧光法成像灵敏度低于化学发光,低丰度蛋白检测不到,并且多重检测需要做大量的实验条件优化,并且随着多重检测靶点数量的增加(避免抗体交叉反应),抗体的选择越来越有难度,此外印迹膜在RGB通道的荧光背景很高,影响成像效果。
生命科学领域发展越来越快,科研也进入到全球范围的高度竞争状态,科研人员要跟全世界的科学家竞争,这种新形势下的竞争对于先进工具的依赖越来越高。易孛特生命科学(上海)有限公司致力于为科学家提供非常先进的创新性工具,帮助中国的科学家在新形势下的激烈竞争中领跑全球。非常感谢您对易孛特的关注和支持!

下载安捷伦电子书《通过细胞代谢揭示新的药物靶点》探索如何通过代谢分析促进您的药物发现研究
10x Genomics新品Visium HD 开启单细胞分辨率的全转录组空间分析!




今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
