
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature Chemical Engineering:上海交大邓楠楠课题组发现界面能调控人工细胞跨膜运输新机制
【字体: 大 中 小 】 时间:2024年07月28日 来源:上海交大 新闻学术网
编辑推荐:
近日,上海交通大学化学化工学院邓楠楠课题组在Nature Chemical Engineering期刊发表题为“Interfacial energy-mediated bulk transport across artificial cell membranes”的研究成果。该成果报道了一种界面能驱动的物质跨仿生细胞膜运输的策略,实现了宏观微液滴、离子和生物大分子等的可逆跨膜转运。论文的第一作者...
近日,上海交通大学化学化工学院邓楠楠课题组在Nature Chemical Engineering期刊发表题为“Interfacial energy-mediated bulk transport across artificial cell membranes”的研究成果。该成果报道了一种界面能驱动的物质跨仿生细胞膜运输的策略,实现了宏观微液滴、离子和生物大分子等的可逆跨膜转运。论文的第一作者为上海交通大学化学化工学院博士生田佳琦,通讯作者为邓楠楠副教授。

“自下而上”构建具有生命结构、功能和行为的人工细胞是人类的巨大挑战之一。从化学化工的角度看,细胞是最复杂、最精密和最高效的生化微反应器,是物质、能量和信息的精妙结合体。人工构建细胞是探索生命奥秘的重要途径,也是推动技术进步和解决全球性问题的一项关键技术。细胞内部复杂的微纳米限域膜结构为生命活动创造了腔室化环境,使成千上万个生化反应过程同时进行又互不干扰。物质和信号的跨膜运输与传递在其中扮演着至关重要的作用,可控地构建双向跨膜运输依然是人工细胞领域存在的重要难题。
面对这一挑战,作者利用具有磷脂双分子层的脂质体囊泡(Liposome)作为人工细胞模型,通过界面调控实现了脂质体囊泡对微液滴(包括油滴、液液相分离水滴和囊泡)的可逆浸润和退浸润过程,模拟出细胞内吞外排行为,并系统研究了通过溶剂挥发、温度变化和渗透压刺激等界面能调控方法对人工细胞膜界面的调控机制,验证了界面能对膜动力学的普适性调控作用。为展示该策略在人工合成细胞方面的潜力,作者进一步将界面能介导的液滴跨膜运输行为与生物分子跨膜传递相结合,实现了离子、酶底物和DNA等生命物质的可逆跨膜运输(Fig. 1),为构建人工细胞生命提供了一种新的视角和方法。
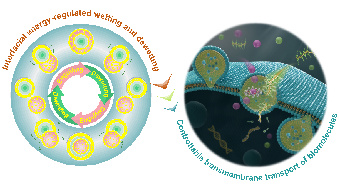
Fig. 1. TOC: from interfacial energy-regulated wetting and dewetting to controllable transmembrane transport of biomolecules
在前期工作基础上,作者利用液滴微流控技术制备处于非平衡态的水包油包水(W1/O/W2)乳液,其中油相包含磷脂分子。在界面能的驱动下,作者意外发现W1/O/W2液滴经历了魔幻版的结构变化循环:液滴首先退浸润过程(Dewetting transition),形成脂质体囊泡和油滴;随后脂质体开始逐步浸润油滴,直至完全吞噬形成具有内油核的囊泡结构;15至20分钟后,脂质体又开始逐渐释放油滴,再次形成分离的脂质体和油滴;最后被释放出的油滴再次反向润湿脂质体,恢复至初始W1/O/W2乳液状态(Fig. 2)。通过界面张力和铺展系数的表征,作者证实了这种脂质体和油滴形态的动态演变是由溶剂挥发导致界面能波动所驱动。通过再次添加溶剂,可使动态行为多次重复发生。
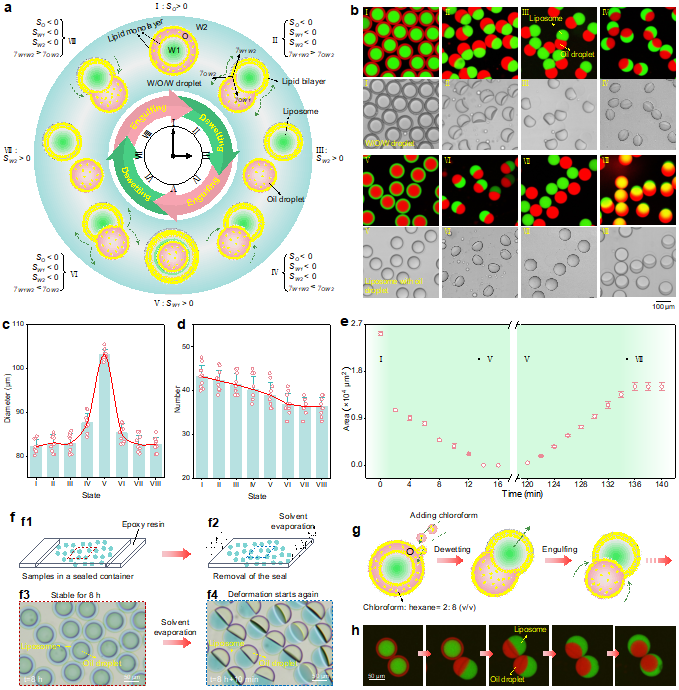
Fig. 2. Morphological evolution between liposomes and oil droplets regulated by solvent evaporation
为了验证界面能调控策略的普适性,作者进一步地探索环境变化刺激产生界面能波动驱动人工细胞膜的界面吞吐行为(Fig. 3)。利用内部含有油滴的脂质体作为研究模型,通过改变环境温度再现了脂质体囊泡对油滴的吞吐。例如,将内部含有油滴的脂质体置于25°C环境中,然后降低温度至4°C,此时观察到脂质体逐步释放其内部的油滴。当温度重新升高至25°C后,脂质体又开始内吞油滴。这一可逆吞吐过程可通过反复加热和冷却实现多次循环。除了温度刺激,作者还发现渗透压变化同样能够诱导脂质体释放内含油滴。例如,在高渗条件下,脂质体失水收缩,内部油滴会自发穿过脂质体膜完全进入外部环境。
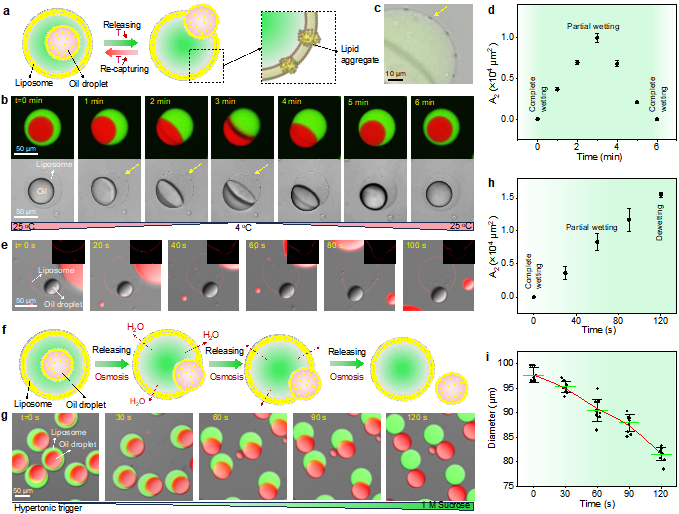
Fig. 3. Bulk transport of oil droplets across liposomal membranes regulated by temperature and osmotic pressure
界面能调控人工细胞膜的吞吐行为可用于人工细胞的物质跨膜传递。为了验证这一设想,作者构建了一种主客体人工细胞模型(Host-guest artificial cell model),其中脂质体作为主体,油滴为客体。这一模型生动地展示了脂质体可利用油滴形成的传输“通道”,实现对不能直接透过脂质双层膜的生物分子的捕获与释放,包括既溶于水又溶于油的分子、油溶性分子,以及水溶性分子,它们各自扮演着重要的生物学角色。
既水溶又油溶分子与油溶性分子的双向跨膜运输:既水溶又油溶分子,如荧光素,可在水相和油相之间转移。作者利用了聚乙烯醇(PVA)与荧光素之间的结合亲和力,通过调节脂质体内外PVA的浓度,实现了主体人工细胞对荧光素分子的可控摄取与释放。当脂质体内的PVA浓度高于外部环境时,随着溶剂的蒸发,脂质体逐渐释放内部的油滴。此时,原本分散在脂质体外的荧光素分子通过油滴通道被有效地富集于脂质体内部。相反,当外部环境中的PVA浓度高于脂质体内时,荧光素分子则通过油滴通道释放到外部环境中(Fig. 4a-f)。此外,在脂质体外环境中分散的油溶性分子,例如非荧光底物丁酸-4-甲基伞形酮(4-MUB),可被油滴溶解并借助油滴的运输作用进入脂质体内部,随后被包埋在主体内的酯酶催化分解,转化为荧光分子。这一生物化学反应的启停,与脂质体对油滴的吞噬和释放过程紧密相连,当脂质体完全吞噬油滴时,反应暂停;而当脂质体释放油滴时,反应继续(Fig. 4g-i)。
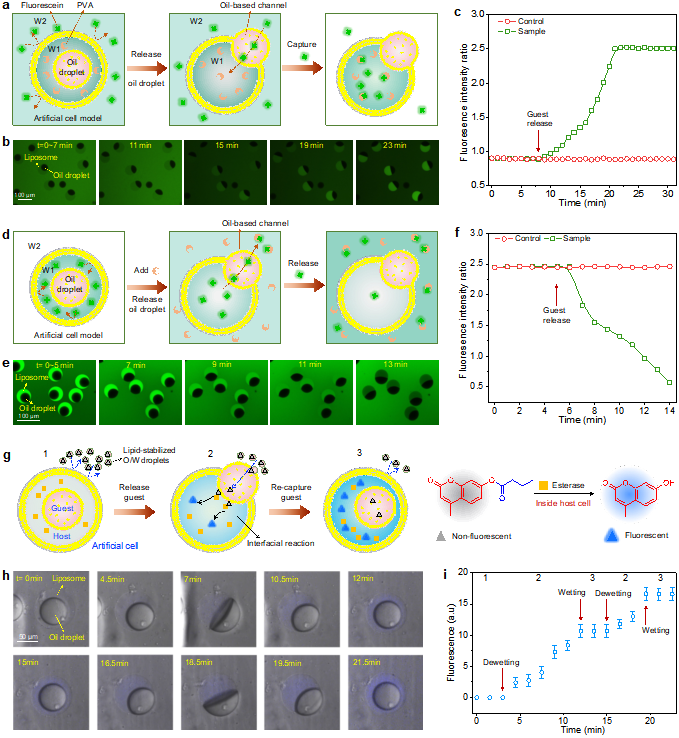
Fig. 4. Controllable transmembrane transport of oil-soluble (including both oil-soluble and water-soluble) molecular cargoes
水溶性物质的跨膜运输:为了转运水溶性生物分子,作者巧妙地借助超分子识别和表界面化学中的分子可逆结合,使得细胞中关键的水溶性物质,如离子和DNA分子,转变为可溶于油的组装体,并通过油滴通道被运输到脂质体内,为水溶性分子的跨膜运输提供了一种全新有效途径(Fig. 5)。以钠离子(Na+)和钾离子(K+)运输为例,作者采用冠醚15-冠-5和18-冠-6作为离子载体,在油滴中形成了具有离子选择性的“离子通道”,伴随主体囊泡对客体油滴的可控释放,成功实现Na+和K+的跨膜定向运输(Fig. 5a-d)。最后,作者探索了DNA分子的跨膜运输。通过使用表面活性剂CTAB将DNA分子修饰为油溶性的DNA-CTAB复合物,使其被主体释放的油滴被收集,随后连同客体一起被吞入主体中。当接触到主体内的盐溶液时,由于电荷相互作用使DNA-CTAB复合物发生解离,DNA分子恢复水溶性,从而被油滴释放到主体脂质体内,完成跨膜运输(Fig. 5e-h)。
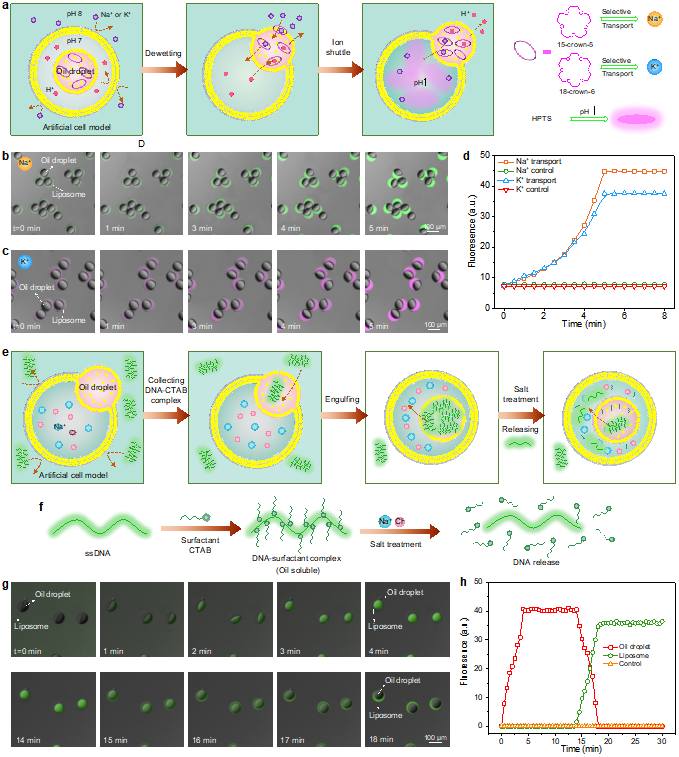
Fig. 5. Controllable transmembrane transport of water-soluble molecular cargoes
在本文中,作者提出一种有效的界面能调控策略用于人工细胞膜的动态重塑,成功实现磷脂双分子层膜与油滴之间的退浸润和再浸润的复杂类生命行为,在人工细胞,特别是人工细胞膜结构和行为仿生领域具有重要理论和应用价值。通过探索超分子化学和界面化学现象,作者提出人工细胞对微液滴的吞吐行为可与生物分子的跨膜运输相耦合,实现了酶底物、离子和DNA等生物分子的定向可逆跨膜转运。油基系统可能存在生物相容性问题,但生物细胞本身也存在油基细胞器,称为脂滴,在内质网膜内形成,参与脂类代谢并为某些生物过程提供场所。作者对生物膜与油滴之间动态相互作用的发现可能与脂滴的分泌机制有关,并提供一种体外仿生研究脂滴生物学行为的方法。同时,本研究有望在模拟细胞行为和开发药物递送系统方面发挥关键作用,为理解早期原始细胞运输机制提供一种新的科学视角。
原文链接:
https://www.nature.com/articles/s44286-024-00088-4
Free PDF access link: https://rdcu.be/dMKyA