
-

生物通官微
陪你抓住生命科技
跳动的脉搏
GUT|上海交通大学公共卫生学院王慧/李晓光团队发现肿瘤细胞与免疫细胞营...
【字体: 大 中 小 】 时间:2024年07月19日 来源:上海交通大学医学院
编辑推荐:
近日,上海交通大学公共卫生学院王慧教授和李晓光研究员团队,在国际消化系统顶级期刊GUT在线发表了题为:Glutamine metabolic competition drives immunosuppressive reprogramming of intratumour GPR109A+ myeloid cells to promote liver cancer progression的研究论文
近日,上海交通大学公共卫生学院王慧教授和李晓光研究员团队,在国际消化系统顶级期刊GUT在线发表了题为:Glutamine metabolic competition drives immunosuppressive reprogramming of intratumour GPR109A+ myeloid cells to promote liver cancer progression的研究论文。该研究发现肿瘤微环境中肝癌细胞和髓系细胞之间存在营养竞争:肝癌细胞通过掠夺谷氨酰胺,驱动髓系细胞发生营养应激和代谢重编程,进而诱导GPR109A+免疫抑制性髓系细胞介导的免疫逃逸和治疗抵抗。该研究具有潜在的公共卫生、肝癌早期筛查和精准治疗的意义。在公众健康领域,该发现为肝癌的早筛提供了新型免疫代谢检查点GPR109A;在疾病治疗领域,在细胞水平精准靶向GPR109A+髓系细胞可以促进免疫杀伤,从而抑制肝癌的恶化进展。该项研究成果将推动基于靶向肿瘤相关髓系细胞的肝癌个体化免疫治疗新策略,填补营养代谢重编程如何调控肝癌进展的分子机制研究方面的空白。

近年来,越来越多的研究表明癌症是由机体内营养物质代谢过程紊乱导致的代谢性疾病。其中,肝脏作为人体内核心代谢器官,通过对葡萄糖、脂质和氨基酸等营养物质的摄取和代谢过程,在维持机体整体代谢稳态中发挥重要的作用。然而,在肝癌发生发展过程中,肿瘤组织通过对营养物质的代谢重编程为自身的恶性生长、增殖与转移提供充足的中间物质与能量。然而,肿瘤微环境的代谢重编程如何损害抗肿瘤免疫反应仍不清楚。
为了解答这一科学问题,王慧和李晓光联合团队成员杨阳和裴天铎等通过利用多个肝癌队列样本和多种肝癌动物模型,发现肝癌肿瘤微环境内存在一群特殊的GPR109A+髓系细胞亚群,该细胞亚群具有强烈的免疫抑制功能,并与肝癌的预后不良密切相关。进一步机制研究发现,肿瘤细胞通过上调SLC1A5与髓系细胞竞争性代谢谷氨酰胺,导致微环境中谷氨酰胺含量匮乏,从而诱发髓系细胞内质网应激并激活IRE1α/XBP1轴促进GPR109A+髓系细胞的形成。随后,微环境中的GPR109A+髓系细胞诱导胞内ERK轴激活并促进趋化因子CXCL1的表达,并产生抑炎状态的极化,从而抑制CD8+ T细胞的抗肿瘤免疫反应,最终形成免疫抑制环路促进肝癌恶性进展。敲除GPR109A或利用GPR109A小分子抑制剂溴美喷酯可有效地打破GPR109A+髓系细胞介导的免疫抑制性肿瘤微环境,激活CD8+ T细胞对肝癌细胞的杀伤功能,并提高免疫治疗的疗效。总之,本研究发现了营养物质如何调控肿瘤微环境中肝癌细胞与髓系细胞之间的细胞通讯和肿瘤免疫逃逸机制,并揭示GPR109A可作为关键的营养-免疫代谢检查点和潜在肝癌免疫治疗靶点。
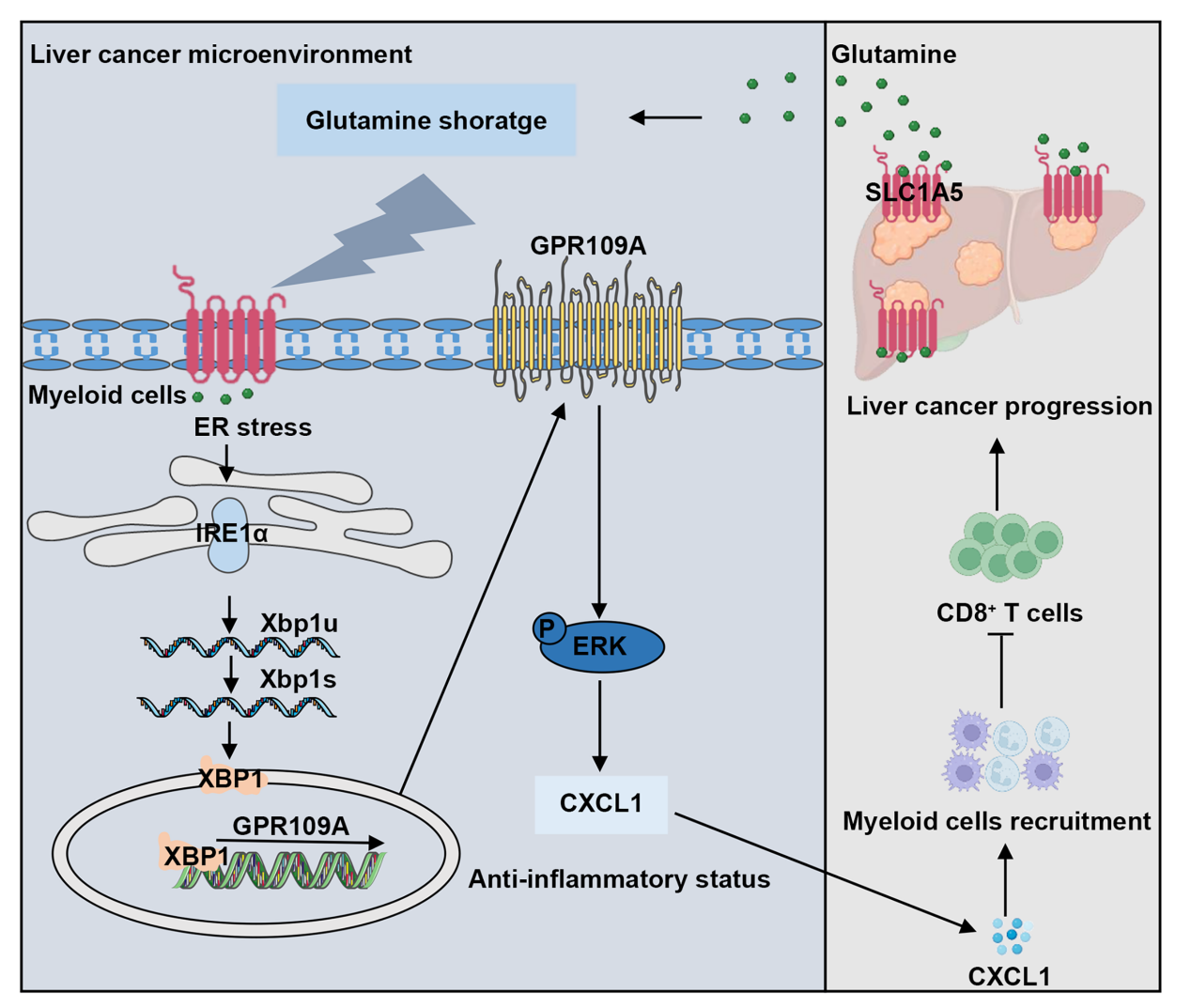
图1. 肝癌微环境中肿瘤细胞和髓系细胞之间的谷氨酰胺代谢竞争调节抗肿瘤免疫的机制
该研究成果不仅为认识肝癌肿瘤微环境内代谢重编程反应提供了新的见解,也为临床肝癌的防治提供了新的干预靶点。GPR109A可作为肝癌进展过程中的新型标志物来优化肝癌患者的早期筛查策略,同时为后续靶向GPR109A开发肝癌治疗策略提供理论基础。
上海交通大学公共卫生学院助理研究员杨阳和博士研究生裴天铎为该文的第一作者,王慧教授和李晓光研究员为该论文的通讯作者。该研究得到了国家重点研发计划、基金委重点项目、上海市自然科学基金、上海市教委创新团队等项目的支持。