
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命科学学院杜鹏课题组发现由DGCR8/FLII/JUN介导的瞬时转录激活事件调控着床期胚胎的形态转变
【字体: 大 中 小 】 时间:2024年07月12日 来源:北京大学新闻网
编辑推荐:
在本研究中,研究者运用na?ve-poised-formative/Primed等干细胞模型,结合实验室先前在miRNA调控方面的研究基础,解释了驱动着床期胚胎形状建成的分子驱动力。
在早期胚胎发育过程中,胚胎着床是一个极为关键的生物学事件。其间胚胎植入母体子宫,建立母胎交流界面,这是后续发育的基础。然而这一过程充满风险,临床上常常出现因着床失败导致的生育问题。由于该过程极为瞬时和动态,胚胎着床方面的研究仍是一个“黑匣子”。
miRNA是真核生物中保守的转录后调控机制,并在着床过程中起到重要作用。DGCR8是miRNA合成通路的核心蛋白,它与DROSHA一起组成Microprocessor复合体,切割pri-miRNA上的茎环结构形成pre-miRNA,pre-miRNA再进一步被加工为成熟的miRNA。1 DCGR8敲除后,胚胎无法发育至着床后阶段,暗示着DGCR8在着床过程中起到重要作用,然而该致死表型却不能完全用miRNA的缺陷来解释。2,3
与尚不清楚的着床期过程相比,人们对于着床前胚胎和着床后的胚胎已有广泛的研究,这主要得益于体外干细胞模型的建立。由着床前胚胎分离得到的干细胞被称为na?ve mESCs(小鼠胚胎干细胞),而着床后胚胎分离得到的干细胞被称为Formative/Primed mESCs,这几种细胞已被广泛应用各种发育问题的研究。4,5 北京大学生命科学学院/北大-清华生命科学联合中心/北京大学核糖核酸北京研究中心的杜鹏教授课题组在2018年捕捉到了一种介于naive和Formative/primed多能性的中间态多能性干细胞,称为Poised mESCs。6,7 该状态代表了处于着床期的胚胎,且由一组特异的miRNA所调控。
2024年7月1日,杜鹏课题组在Molecular cell杂志在线发表了题为“A transient transcriptional activation governs unpolarized-to-polarized morphogenesis during embryo implantation”的研究论文。在本研究中,研究者运用na?ve-poised-formative/Primed等干细胞模型,结合实验室先前在miRNA调控方面的研究基础,解释了驱动着床期胚胎形状建成的分子驱动力,主要内容概括如下:
1. DGCR8作为miRNA合成通路的核心蛋白,可以发挥不依赖于miRNA的转录抑制的非经典功能。在na?ve mESCs中(代表着床前胚胎),DGCR8可以结合位于mRNA上短的茎环结构,招募并隔离转录激活子FLII,抑制转录进行。在Poised mESCs中(代表着床中胚胎),ERK通路瞬时激活,使得FLII受到磷酸化修饰并与DGCR8解离,进而与转录因子JUN结合并激活细胞迁移基因的转录。着床后ERK通路迅速失活(Formative mESCs),DGCR8重新结合并抑制FLII。因此DGCR8/FLII/JUN在ERK通路的介导下,在着床期特异地介导了一个瞬时转录激活事件的发生(图1)。
2. 该转录激活事件控制了胚胎着床期由无序状态到极化状态的形态转变,且该事件在人和小鼠是保守的(图1)。
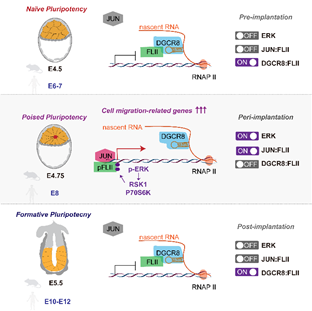
图1. 在着床前(naive)-着床中(Poised)-着床后(Formative)发育过程中,DGCR8/FLII/JUN在ERK通路调控下介导瞬时转录激活事件的发生,进而调控着床期胚胎形态转变
本研究具体结论如下:
一、在na?ve mESCs中,DGCR8通过结合mRNA上的茎环结构,招募并抑制转录激活子FLII。
基于前期的na?ve小鼠胚胎干细胞中DGCR8互作蛋白数据/Co-IP/Pull down,作者发现,DGCR8与转录激活子FLII存在直接的蛋白相互作用。然而FLII并不参与miRNA合成通路。进一步的通过遗传学手段,作者发现:DGCR8和FLII共同在转录水平上控制了一组不受miRNA调控的基因,该类基因主要参与细胞迁移等活动,称为非miRNA靶向基因。DGCR8可以抑制,但FLII可以激活此类基因的转录。
为了进一步研究DGCR8如何抑制这类基因的转录,在na?ve小鼠胚胎干细胞中,作者通过eCLIP实验鉴定了DGCR8/FLII的RNA结合靶点,同时在eCLIP实验中还掺入了S4U,可以同时鉴定出新生的RNA(nascent RNA)。作者发现DGCR8和FLII同时结合了大量的靶基因的新生mRNA,且DGCR8结合区域倾向于形成茎环结构。该茎环结构显著短于pri-miRNA上的茎环结构,并不能被DGCR8和DROSHA形成的复合体结合并切割。通过敲除DGCR8所结合的位于靶基因mRNA上的茎环结构,靶基因的转录抑制状态被解除。这证明DGCR8确实通过结合mRNA上的茎环结构来抑制转录。
综上,这说明DGCR8一方面和DROSHA结合负责pri-miRNA的切割,一方面结合在靶基因mRNA上的茎环结构,招募并抑制转录激活子FLII,从而抑制转录的进行(图2)。
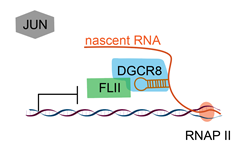
图2. 在na?ve(代表着床前胚胎)小鼠胚胎干细胞中,DGCR8结合靶基因mRNA上的茎环结构,招募并隔离转录激活子FLII,抑制转录进行
二、FLII在Poised mESCs(代表着床期胚胎)中与DGCR8解离,并与转录因子JUN结合,激活基因转录。
通过na?ve-poised(着床前→着床中)转变体系,作者发现:FLII在只有在Poised时期(着床中)才具有转录激活活性,而在na?ve时期(着床前)则没有。与此对应的是FLII在Poised时期解除了与DGCR8的互作,同时也不再结合靶基因的mRNA。这说明FLII与DGCR8的解离是FLII具有转录激活活性的关键条件。通过一系列生化实验,作者证明na?ve-poised转变过程中,ERK通路瞬时激活,磷酸化FLII,使得FLII与DGCR8不再结合。同时磷酸化的FLII会与转录因子JUN互作增强(图3)。进一步的通过JUN的CUT&Tag实验发现,JUN可以广泛结合在FLII激活的靶基因上,且JUN在Flii敲除中的细胞中无法结合靶基因。这说明JUN只有与FLII结合才能够结合靶基因,激活其转录(图3)。
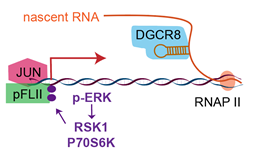
图3. 在Poised(代表着床中的胚胎)小鼠胚胎干细胞中,ERK激活诱导DGCR8与FLII的解离,促进FLII与JUN形成新的复合体激活基因转录
三、Poised mESCs代表小鼠和人的着床期胚胎,这一时期的胚胎正经历无序到极化的形态转变。
通过与体内胚胎的转录组比较,作者发现Poised ESCs的转录组与小鼠与人的着床期胚胎转录组最为相似(小鼠为E4.75天,人为E8天)。这一时期胚胎的上胚层细胞逐渐从无序状态变成玫瑰花环样的极化结构。且在体外培养的着床期小鼠胚胎中,能够观察到JUN和其他静息态多能性标记基因的表达,进一步证明了已有结论。通过体外的模拟无序到极化的形态转变体系,作者发现抑制该转录激活事件都会导致无序到极化结构形态转变的失败。因此,本文中鉴定到的转录激活事件对应于着床期胚胎,而激活基因以细胞迁移相关基因为主,则对应着这一时期细胞的形态转变(图4)。
综上,该研究发现了DGCR8独立于miRNA之外的转录抑制功能,并与FLII/JUN一起,在ERK通路的控制下,控制了着床期的瞬时转录激活事件,进而控制这一时期的形态建成。
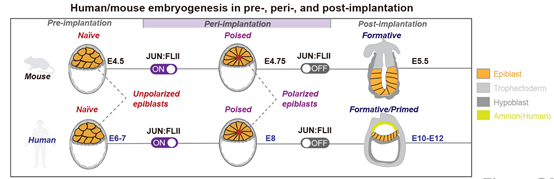
图4. Poised ESCs(静息态多能性干细胞)代表着床期的小鼠/人胚胎,其epiblast正经历无序到极化的形态转变。本文鉴定的转录激活事件对应于这一形态转变过程
杜鹏为该论文的通讯作者。北京大学生命科学学院博士后吕学晖、崔英姿,前沿交叉学科研究院博士后孔寅飞为本文的并列第一作者。北京大学博士毕业生杨敏、博士后申辉、博士后李诗雨、已出站博士后翁建莉,北京大学张哲研究员及其博士生廖述筠,中国科学院动物研究所王皓毅研究员及其博士毕业生安辰瑞,山东大学李艳研究员对本文有重要贡献。该项工作得到了国家重点研发计划,国家自然科学基金的支持。
参考文献:
1. DeVeale, B., Swindlehurst-Chan, J., and Blelloch, R. (2021). The roles of microRNAs in mouse development. Nat Rev Genet 22 , 307—323. 10.1038/s41576-020-00309-5.
2. Greve, T.S., Judson, R.L., and Blelloch, R. (2013). microRNA control of mouse and human pluripotent stem cell behavior. Annu Rev Cell Dev Biol 29 , 213-239. 10.1146/annurev-cellbio-101512—122343.
3. Wu, Q., Song, R., Ortogero, N., Zheng, H., Evanoff, R., Small, C.L., Griswold, M.D., Namekawa, S.H., Royo, H., Turner, J.M., and Yan, W. (2012). The RNase III enzyme DROSHA is essential for microRNA production and spermatogenesis. J Biol Chem 287 , 25173—25190. 10.1074/jbc.M112.362053.
4. Kinoshita, M., Barber, M., Mansfield, W., Cui, Y., Spindlow, D., Stirparo, G.G., Dietmann, S., Nichols, J., and Smith, A. (2021). Capture of Mouse and Human Stem Cells with Features of Formative Pluripotency. Cell Stem Cell 28 , 2180. 10.1016/j.stem.2021.11.002.
5. Wang, X., Xiang, Y., Yu, Y., Wang, R., Zhang, Y., Xu, Q., Sun, H., Zhao, Z.A., Jiang, X., Wang, X., et al. (2021). Formative pluripotent stem cells show features of epiblast cells poised for gastrulation. Cell Res 31 , 526—541. 10.1038/s41422-021-00477-x.
6. Du, P., Pirouz, M., Choi, J., Huebner, A.J., Clement, K., Meissner, A., Hochedlinger, K., and Gregory, R.I. (2018). An Intermediate Pluripotent State Controlled by MicroRNAs Is Required for the Naive-to-Primed Stem Cell Transition. Cell Stem Cell 22 , 851—864 e855. 10.1016/j.stem.2018.04.021.
7. Du, P., Wang, L., Sliz, P., and Gregory, R.I. (2015). A Biogenesis Step Upstream of Microprocessor Controls miR-17~92 Expression. Cell 162 , 885—899. 10.1016/j.cell.2015.07.008.