
-

生物通官微
陪你抓住生命科技
跳动的脉搏
中外学者Nature发文:新型anti-CRISPR蛋白的作用机理
【字体: 大 中 小 】 时间:2024年07月08日 来源:中国科学院生物物理研究所
编辑推荐:
2024年7月3日,中国科学院生物物理研究所王艳丽团队与加拿大多伦多大学Alan Davidson团队合作,在《Nature》杂志在线发表了题为"An anti-CRISPR that pulls a...
CRISPR-Cas系统作为自然界中存在的强大基因编辑工具,广泛分布于细菌和古生菌中,有效抵御外源DNA的入侵。作为反击,病毒进化出了anti-CRISPR蛋白(Acr),抑制CRISPR-Cas系统的活性。目前,科学家们已发现近百种Acr蛋白,这些蛋白通过多样化的机制发挥功能。
2024年7月3日,中国科学院生物物理研究所王艳丽团队与加拿大多伦多大学Alan Davidson团队合作,在《Nature》杂志在线发表了题为"An anti-CRISPR that pulls apart a CRISPR-Cas complex"的研究论文,揭示了新型anti-CRISPR蛋白AcrIF25的独特作用机制,通过解离I-F型CRISPR-Cas复合体(Csy复合体)的方式抑制CRISPR-Cas系统的活性。
研究团队发现AcrIF25是一种能够特异性抑制I-F型CRISPR-Cas系统(Csy复合体)的新型anti-CRISPR蛋白。在I-F型系统中,Csy复合体由crRNA和4种Cas蛋白组成,共同识别外源核酸。已知的Acr蛋白大多通过直接结合Csy复合体来抑制其功能,但AcrIF25却展现了与众不同的作用方式。AcrIF25并不直接结合完整的Csy复合体,而是特异性地结合并分离出其中的Cas7亚基,导致Csy复合体解体,从而阻断CRISPR-Cas系统的正常功能。
研究团队解析了AcrIF25以及Cas7:AcrIF25复合体的晶体结构,发现AcrIF25通过其C端结构域与Cas7形成广泛相互作用,覆盖了Cas7亚基之间及Cas7与crRNA的结合界面。因此,AcrIF25与Cas7结合能够阻断Cas7与相邻Cas7亚基及crRNA相互作用,进而使得整个Csy复合体解体,实现了对Csy复合体的精准"拆除"。
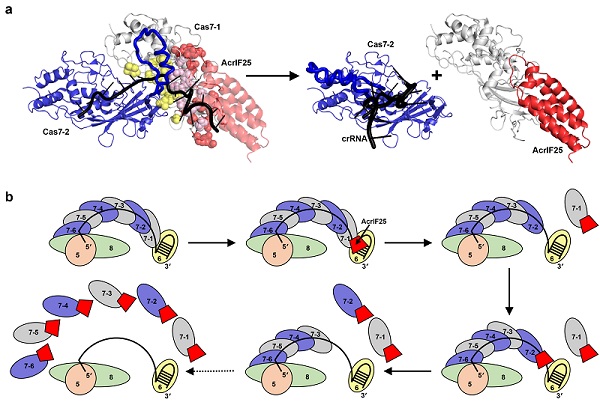
图1. AcrIF25解离Csy复合体的分子机制
值得注意的是,AcrIF25在解离Cas7时无需依赖ATP水解提供的能量,这也是首次发现无需额外能量供应即可解离大型蛋白核酸复合物的案例。该研究不仅丰富了我们对Acr蛋白作用机制的认识,也为未来开发新型基因编辑工具提供了宝贵的线索。
中国科学院生物物理研究所的王艳丽研究员和多伦多大学的Alan Davidson教授为论文的共同通讯作者,该研究得到了国家自然科学基金、科技部、中国科学院和北京市科学技术委员会的资助,上海同步辐射光源(SSRF)为该研究提供了重要的技术支持。
文章链接:https://www.nature.com/articles/s41586-024-07642-3
?
(供稿:王艳丽研究组)
?