
-

生物通官微
陪你抓住生命科技
跳动的脉搏
【JMC封面】朱棣/孟祥璟/赵玉军等报道新型靶向β-catenin/BCL9
的小分子PPI抑制剂, 激活cDC1的抗原提呈和肿瘤免疫响应
【字体: 大 中 小 】 时间:2024年06月27日 来源:复旦大学
编辑推荐:
2024年,复旦大学基础医学院朱棣教授、山东省药学科学院孟祥璟研究员、及中国科学院上海药物研究所赵玉军研究员共同通讯在Journal of Medicinal Chemistry 发表的题为“Discovery of Novel 1-Phenylpiperidine Urea-Containing Derivatives Inhibiting β-Catenin/BCL9 Interaction and Exerting Antitumor Efficacy through the Activation of Antigen Presentation of cDC1 Cells”的研究论文已上线。
Wnt/β-catenin信号通路的异常激活与多种肿瘤的发生、增殖、转移以及抗肿瘤免疫逃逸密切相关,是开发肿瘤治疗药物新兴的、极具潜力的靶点。在正常生理情况下,Wnt信号通过调控β-catenin的稳定性和细胞核内积累来调控细胞的命运。然而,在肿瘤细胞中,Wnt信号的异常激活导致细胞内去磷酸化的β-catenin水平显著升高,进而在细胞核内积聚,并与T细胞因子(TCF)和其他共转录因子如BCL9、CREB结合蛋白(CBP)及p300等结合,形成转录激活复合体,启动下游致癌基因的表达。鉴于此,直接阻断β-catenin与其核内共转录因子的相互作用成为抑制Wnt/β-catenin信号异常激活的有效策略之一。
BCL9是Wnt信号通路核心共转录因子,71.5%晚期肝癌出现BCL9基因高表达,40%结肠癌BCL9基因表达异常升高,是肠癌肝转移原位灶和转移灶之间动态调控关键分子,并与肝癌患者生存负相关。但是,目前BCL9调控肿瘤转移和免疫治疗耐药的机制不明。靶向BCL9/BCL9L的研究表明抑制BCL9/BCL9L能够调控浆细胞转移、T细胞浸润、B细胞迁移、树突状细胞活化等多个肿瘤免疫相关的过程,不但抑制肿瘤细胞的增殖和转移,而且增强免疫系统对肿瘤细胞的识别和清除,提高抗肿瘤免疫疗法的效果。BCL9/BCL9L作为免疫治疗肿瘤耐药和转移的新靶点,对肿瘤免疫治疗具有重要研究价值,该课题组在该领域的研究成果多次发表于Nature Medicine,Signal Transduction and Targeted Therapy,Science Advances,Cell Reports等期刊。因此,探索β-catenin与核内共转录因子BCL9的相互作用的结构基础,将有助于开发更具特异性和高效性的靶向药物,有望推动基于调控Wnt/β-catenin信号通路的治疗策略,在临床上取得应用。
2024年,复旦大学基础医学院朱棣教授、山东省药学科学院孟祥璟研究员、及中国科学院上海药物研究所赵玉军研究员共同通讯在Journal of Medicinal Chemistry 发表的题为“Discovery of Novel 1-Phenylpiperidine Urea-Containing Derivatives Inhibiting β-Catenin/BCL9 Interaction and Exerting Antitumor Efficacy through the Activation of Antigen Presentation of cDC1 Cells”的研究论文已上线。合作团队在β-catenin研究领域取得了新的重大突破,首次提出了两种新的β-catenin构象(PDB IDs 8Z61, 8Z5J),并深入剖析了BCL9结合位点几种β-catenin晶体结构的构象动力学。基于上述结构分析,团队设计合成了一类具有尿素结构的化合物(13, 28, 35),能够高效阻断β-catenin/BCL9相互作用,显著激活cDC1的抗原提呈和免疫响应。该研究成果即将作为JMC补充封面进行正式发表(7月8日第13期封面,https://doi.org/10.1021/acs.jmedchem.3c02079)。

首先,基于2GL7结构,对β-catenin N端的四个α螺旋进行了叠加分析,选择叠合度较差的晶体(PDB IDs 2GL7, 8Z61, 8Z5J)进行进一步研究,结果显示β-catenin N末端存在显著的构象多样性,主链之间的错位现象表明这些区域可能存在潜在的构象变化或不稳定性。150 ns的分子动力学模拟分析显示尽管晶体蛋白在模拟条件下相对稳定,但N端区域可能具有独特的结构和稳定性特征。这一发现对于β-catenin/BCL9相互作用研究具有重要意义,提示β-catenin的N端在生理条件下可能会发生构象变化,从而影响其相互作用和功能。上述结果是对于β-catenin N端区域构象变化的首次详细研究。
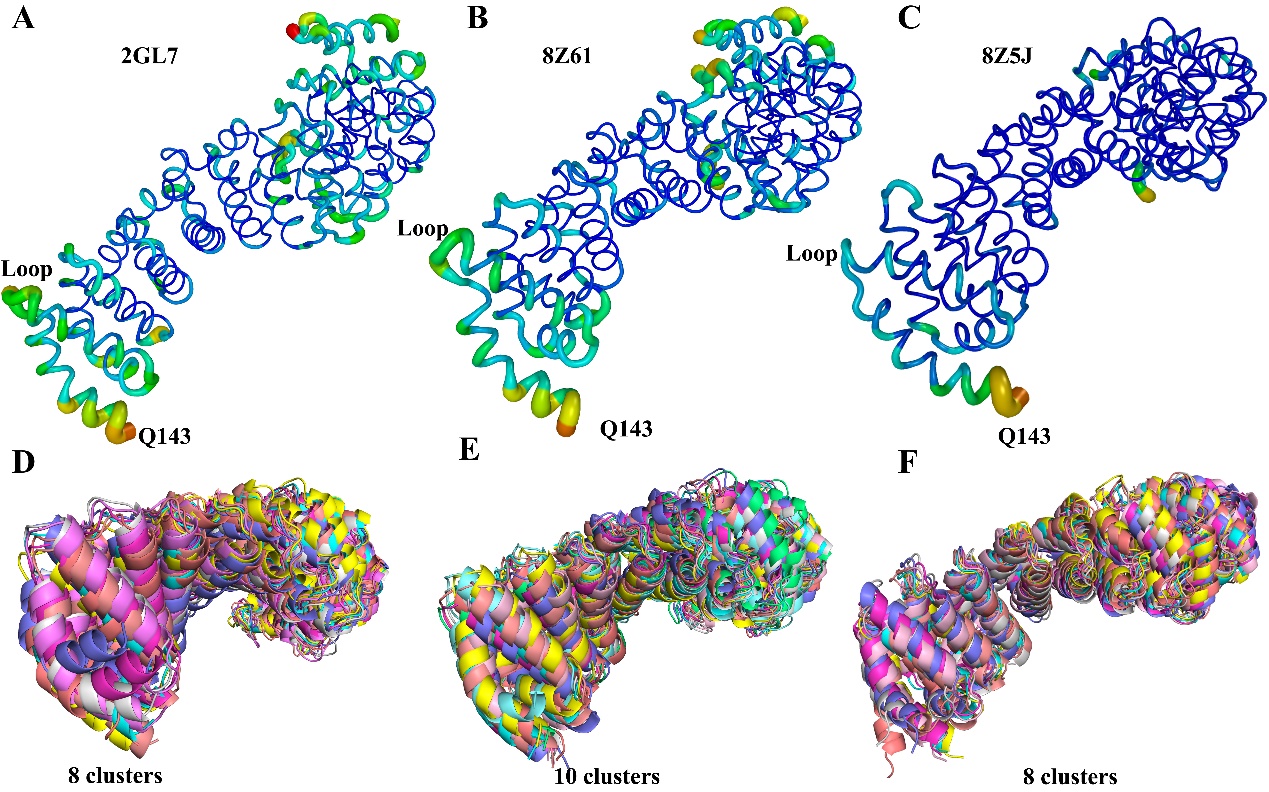
图1. 三种β-catenin晶体动力学稳定性特征及聚类结构
其次,为了研究抑制剂与Apo β-catenin构象的相容性,研究团队选择了分别从8Z61和8Z5J的分子动力学模拟中的主导聚类结构(DC I和DC II),并将之用于分子设计。在ZW4864的基础上,采用尿素优势骨架,最终成功获得了一系列高亲和力、高活性的具有3-苯基哌啶尿素结构的衍生物。通过上述结构改造,新化合物的亲和力从亚微摩尔级别突破到了纳摩尔级别,其中化合物28显示出目前该领域最强的β-catenin结合亲和力(Kd=82 nM)。
最终,所获得先导化合物13和35具有显著的体内抗癌活性,不仅激活T细胞,还促进cDC1的抗原呈递,并在CT26模型中展示出强效的抗肿瘤效应。并且研究团队还利用深势科技的Hermite平台技术(https://hermite.dp.tech, DP Technology),计算了13和35与β-catenin自由结合能,结果表明,相比35,13与β-catenin具有更稳定的结合。
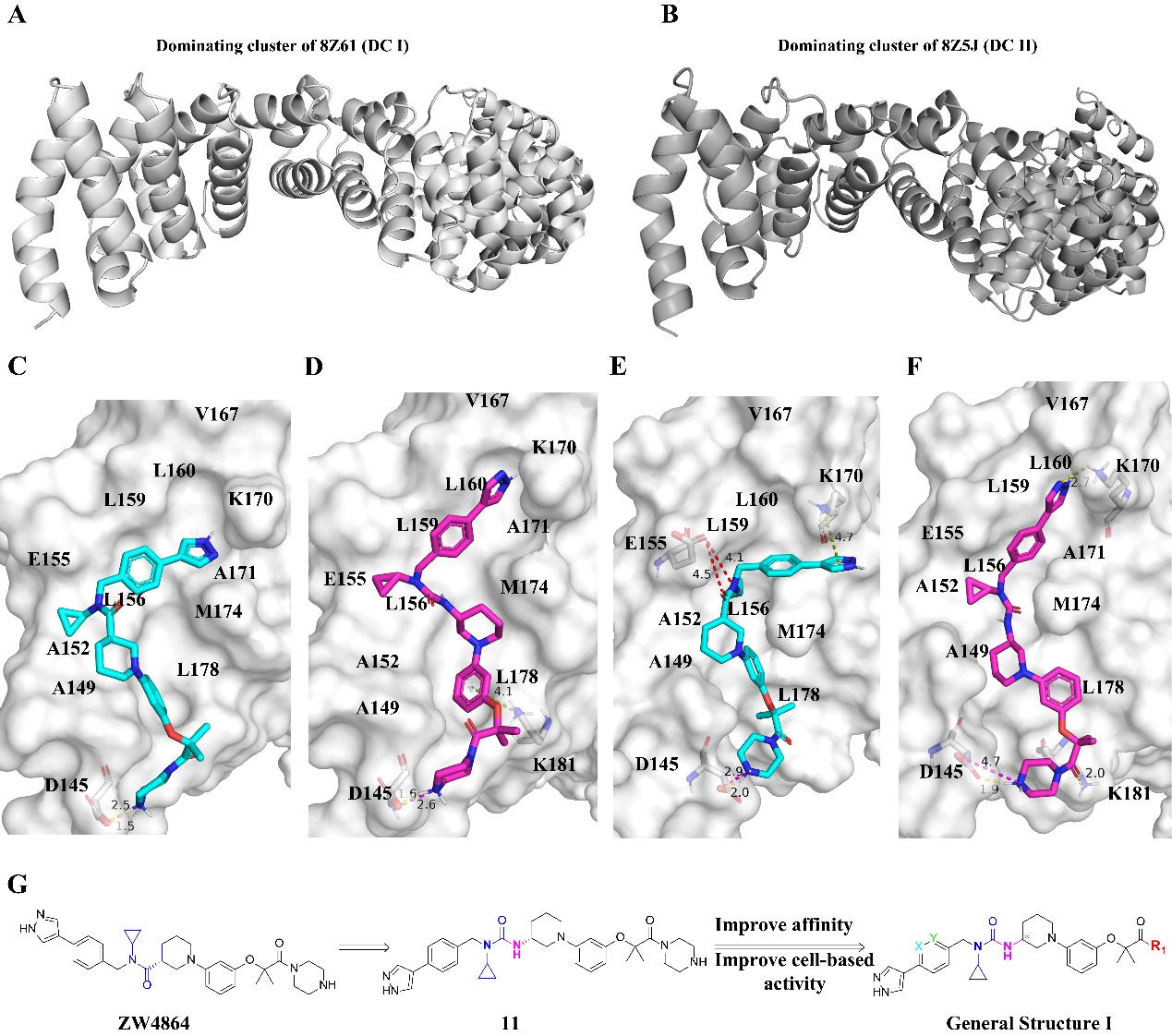
图2. Apo β-catenin 主导聚类结构及3-苯基哌啶尿素衍生物的设计策略
肿瘤组织流式细胞术和qPCR研究表明化合物13增强了免疫细胞的浸润,促进了抗原呈递基因的表达。化合物13处理后,IFN-γ+和颗粒酶B+CD8+T 细胞的肿瘤浸润率显著高于载体组。此外,抗原呈递基因Psmb8和H2-Aa的表达上调,证实了抗原呈递相关基因增强,从而启动下游T细胞活化并增加免疫细胞肿瘤浸润。在作用机理方面,化合物13通过Btk-Irf1信号转导轴激活癌症免疫反应,不仅上调IFN-γ+ CD8+ T细胞,而且促进抗原呈递刺激cDC1细胞成熟,表现出强大的免疫增强活性。
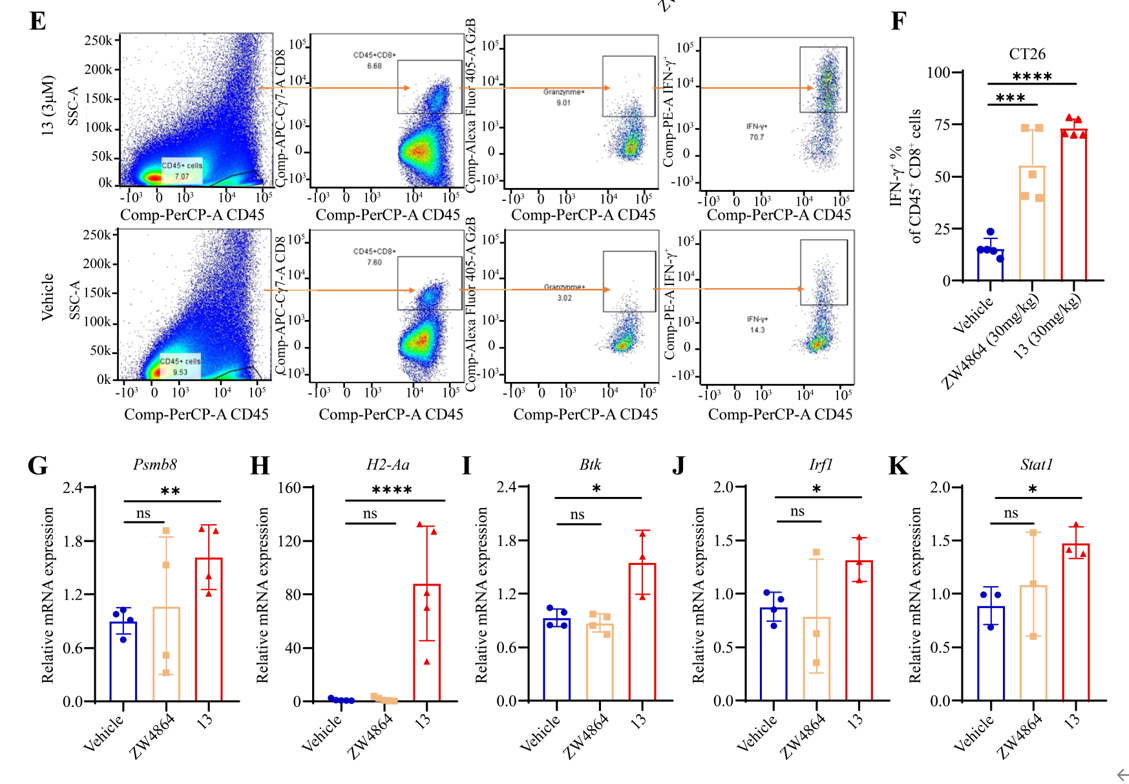
图3. 化合物13治疗的体内肿瘤免疫微环境调控
进一步的研究表明,阻断BCL9/β-catenin蛋白质相互作用可以增强cDC1细胞中的抗原呈递,并具有促进cDC1激活的重要作用。化合物35不仅增强了cDC1的抗原呈递和激活,还提升了PBMC和TdLN中的cDC1比例,从而增强了T细胞介导的免疫反应。该研究揭示了阻断BCL9/β-catenin蛋白质相互作用抗肿瘤的全新药理机制,同时具备抑制肿瘤细胞生长、引发cDC1细胞及激活T细胞三重功效。在作用机理方面,化合物35通过激活Btk-Stat-Irf1信号转导轴,促进cDC1细胞的分化和成熟。
综上所述,该合作团队首次报道了具有3-苯基哌啶尿素结构的、新颖的BCL9/β-catenin小分子抑制剂。这类抑制剂的可通过增强肿瘤微环境中cDC1细胞的抗原呈递,实现抗肿瘤效应。
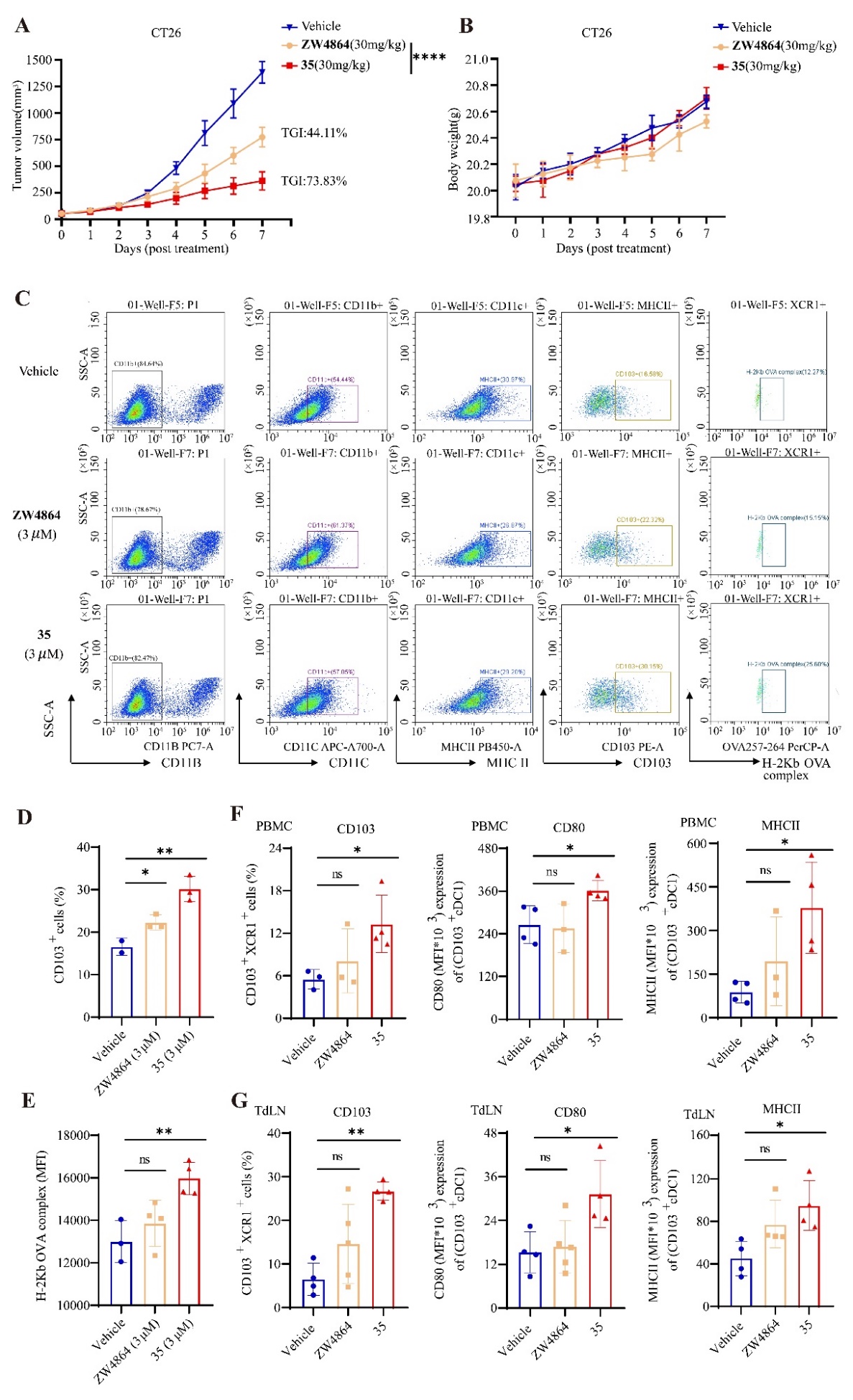
图4. 35调节CT26模型淋巴结中的免疫微环境
以上研究成果安徽中医药大学和长三角药物高等研究硕士生朱文华为第一作者,安徽中医药大学和长三角药物高等研究院联培硕士生刘翠婷,奚康,李雅娜;复旦大学博士生李安琪,硕士生沈栎安为共同第一作者。
在2022年,中国医药工业研究总院张庆伟教授和李建其教授团队联合复旦大学基础医学院朱棣教授团队在药物化学领域的国际顶级期刊《Journal of Medicinal Chemistry》上发表了一篇综述性文章。该综述系统地总结了近年来在识别多肽和小分子抑制剂方面取得的最新进展,这些抑制剂能够直接破坏Wnt/β-catenin信号通路中β-catenin与其核内结合蛋白的相互作用。详细探讨了开发针对β-catenin及其核内结合蛋白相互作用的类药物抑制剂所面临的关键挑战,包括识别抑制剂的特异性和有效性、优化药代动力学性质,以及克服细胞内靶点可接近性等问题。综述强调了这些策略在抗肿瘤药物开发中的潜在应用,并提出了未来研究的方向,以进一步推动基于Wnt/β-catenin信号通路的精准治疗策略的发展。

同年,该联合团队针对槲皮素及衍生物难成药问题,参考已有文献对槲皮素多个抗肿瘤活性潜在位点(3’位,5位,7位和8位)进行修饰,经体外酶水平、抗肿瘤细胞增殖活性及qPCR活性测试,发现槲皮素3’-OH位衍生物C1对CT26小鼠结肠癌细胞和HCT116人结肠癌细胞抗增殖活性较槲皮素相比均显著提高,活性提升了约2-5倍,且C1具有较好的肿瘤细胞透过性,在 HCT116细胞透过率为31.31%。该研究以天然产物槲皮素为母核,通过成药性优化,发现新型靶向β-catenin/BCL9相互作用小分子C1为结直肠癌靶向药物的发现提供参考与借鉴。

2023年,该研究团队基于具有一定成药潜力的苯基哌啶骨架开展了研究,通过分子对接技术确定了化合物与蛋白质的结合模式,经过三轮先导物的结构优化,最终发现化合物41在体外对蛋白的半抑制浓度(IC50)为0.72μM,在细胞中的IC50为0.66μM,分别比先导化合物提高了7倍和18倍。初步药物代谢研究表明,化合物41在人类、小鼠和大鼠的肝微粒体中具有稳定的代谢性能。在CT26肿瘤体内模型中,化合物41显示出浓度依赖性的抑制肿瘤生长效果。此外,与PD-1抗体联合应用后,化合物41的体内抑瘤率得到进一步提高,明显优于单独应用化合物41或PD-1抗体的效果。通过进一步药效机制探索,发现化合物41与PD-1抗体联用能促进CTL的浸润和功能,并减少Tregs的浸润。这些结果表明,化合物41与PD-1抗体联合应用能增强抗肿瘤免疫响应,对结直肠癌治疗具有显著的协同效应。该研究成果还获选成为当期Journal of Medicinal Chemistry的封面文章,这是对靶向BCL9/BCL9L抑制剂药物开发研究工作的关键里程碑。


连续两年针对BCL9小分子抑制剂的药物开发的研究成果发表在药物化学专业国际顶级期刊Journal of Medicinal Chemistry上,并且都获得权威性期刊的封面推荐,不但体现BCL9/β-catenin抑制剂的研究工作具有的创新性和研究价值,而且说明靶向BCL9/BCL9L的药物开发蕴藏着巨大潜力。
1. Wenhua Zhu, Cuiting Liu, Kang Xi, Anqi Li, Li-an Shen, Yana Lia, Miaomiao Jia, Yangbo He, Gang Chen, Chenglong Liu, Yangqiang Chen, Kai Chen, Fan Sun, Daizhou Zhang, Chonggang Duan, Heng Wang, Dongdong Wang, Yujun Zhao*, Xiangjing Meng*, Di Zhu*. Discovery of Novel 1-Phenylpiperidine Urea-Containing Derivatives Inhibiting β-Catenin/BCL9 Interaction and Exerting Antitumor Efficacy Through the Activation of Antigen Presentation of cDC1 Cells. J. Med. Chem. 2024, DOI: 10.1021/acs.jmedchem.3c02079.
2. Hao Zhang, Chenglong Liu, Qiushi Chen, Li-An Shen, Wenting Xiao, Jiayi Li, Yonghui Wang*, Di Zhu*, Qingwei Zhang*, and Jianqi Li*. Discovery of Novel 3-Phenylpiperidine Derivatives Targeting the β-Catenin/B-Cell Lymphoma 9 Interaction as a Single Agent and in Combination with the Anti-PD-1 Antibody for the Treatment of Colorectal Cancer. J. Med. Chem., 2023, 66, 1349–1379, DOI: 10.1021/acs.jmedchem.2c01568
3. Li-An Shen , Xinyan Peng , Ya Bao , Chenglong Liu , Hao Zhang, Jianqi Li , Di Zhu , Qingwei Zhang. Design, synthesis and biological evaluation of quercetin derivatives as novel β-catenin/B-cell lymphoma 9 protein-protein interaction inhibitors. Eur J Med Chem. 2023:247:115075.
4. Hao Zhang, Chenglong Liu , Di Zhu, Qingwei Zhang , Jianqi Li. Medicinal Chemistry Strategies for the Development of Inhibitors Disrupting β-Catenin's Interactions with Its Nuclear Partners. J Med Chem.. 2023;66(1):1-31.
 生物通微信公众号
生物通微信公众号
知名企业招聘