
-

生物通官微
陪你抓住生命科技
跳动的脉搏
北京大学第三医院临床流行病学研究中心詹思延教授团队发表最新成果
【字体: 大 中 小 】 时间:2024年06月29日 来源:北京大学医学部
编辑推荐:
2024年6月19日,北京大学第三医院临床流行病学研究中心詹思延教授团队在中科院一区期刊《基因组医学》(Genome Medicine)在线发表关于慢性肾脏病多组学药物靶点的最新研究成果,论文题目为《整合多组学蛋白质组和转录组确定慢性肾病和肾功能的新型治疗靶点》(Identifcation of novel therapeutic targets for chronic kidney disease and kidney function by integrating multi-omics proteome with transcriptome),该研究揭示了多个慢性肾脏病治疗的潜在新靶点
2024年6月19日,北京大学第三医院临床流行病学研究中心詹思延教授团队在中科院一区期刊《基因组医学》(Genome Medicine)在线发表关于慢性肾脏病多组学药物靶点的最新研究成果,论文题目为《整合多组学蛋白质组和转录组确定慢性肾病和肾功能的新型治疗靶点》(Identifcation of novel therapeutic targets for chronic kidney disease and kidney function by integrating multi-omics proteome with transcriptome),该研究揭示了多个慢性肾脏病治疗的潜在新靶点。
论文截图
慢性肾脏病(CKD)是一种严重的慢性疾病,影响全球高达10%的人口。CKD患者通常会随着病程增加而持续进展并面临多种不良结局的风险,包括心血管事件、终末期肾病、甚至死亡等。
然而,这种患病率高、预后较差的慢性疾病目前在临床上尚缺乏有效的治愈措施,亟需更深入地识别能够调控CKD风险的潜在标志物,为CKD靶向治疗提供新的见解。
既往的全基因组关联研究(GWAS)已经确定了数百个与CKD和肾功能相关的位点,但由于遗传位点通常位于生物学机制的最上游,到实现临床治疗靶点的转化还有很长的距离。目前的血浆蛋白质组、转录组(mRNA)等可以实现对潜在靶标进行高通量分析和鉴定,为新药靶点挖掘提供了重要的基础。
为此,研究团队整合了多个大型血浆蛋白质组和转录组的GWAS数据,通过自主设计的综合性分析策略,包括蛋白组范围的孟德尔随机化分析、转录组范围的孟德尔随机化分析、共定位分析等多种统计遗传学分析方法,从多组学数据中筛选出对慢性肾脏病具有潜在影响的靶点,为CKD的治疗和新药研发提供了重要的参考依据。
研究团队汇总了Iceland、UK Biobank、Fenland等三个目前最大的蛋白组学研究数据库,获取了超过3000种蛋白质数据,利用蛋白组范围的孟德尔随机化分析和多重校正策略确定了32个与CKD密切相关的关键蛋白。
随后,研究团队将这32个蛋白与29个相应的编码基因相匹配,通过整合多个转录组的数据,进一步验证这些蛋白的编码基因在不同人体组织中的表达与CKD的相关性和潜在的脱靶效应。通过对更广泛的CKD结局进行验证分析,本研究发现的蛋白靶点与来自不同人群的慢性肾脏病、肾功能指标、肾功能变化、以及特定的CKD临床类型等多个表型均存在一定的相关性。
值得注意的是,该研究所报道的32个蛋白靶点中,多个蛋白与CKD呈现出高度“共定位”,数个靶点之间存在“蛋白-蛋白相互作用”,且这些蛋白的编码基因主要富集在“免疫相关通路”中。
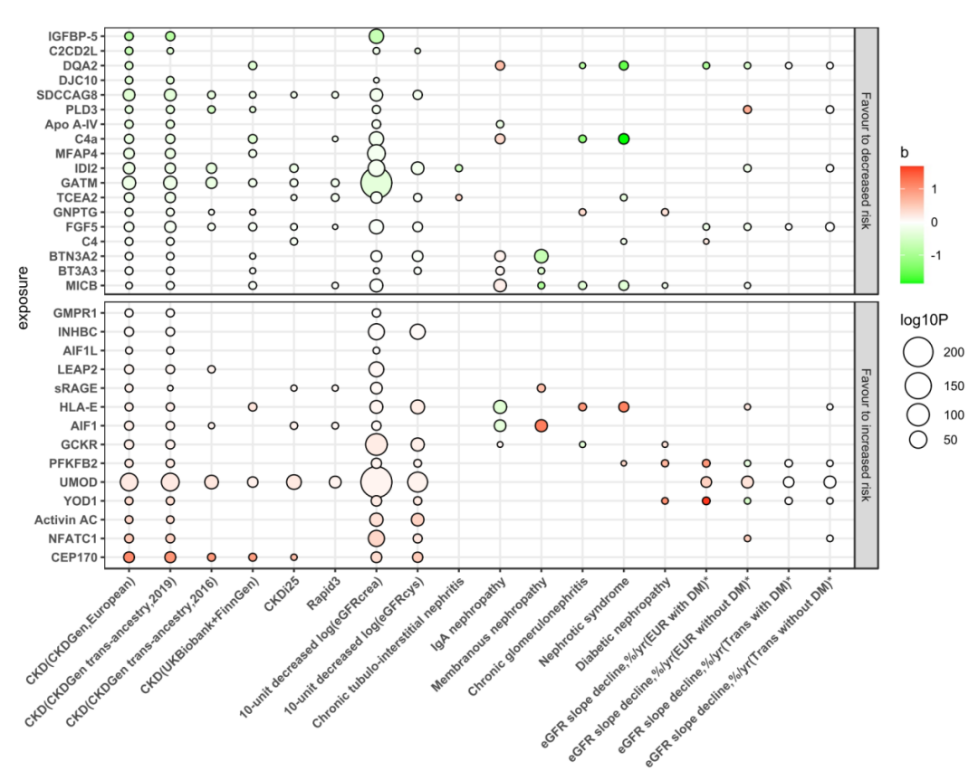
筛选的蛋白靶点与广泛的CKD相关表型之间的关联结果
研究团队通过文献综述总结和对比先前的孟德尔随机化和观察性研究,确定了在本研究发现的32个靶点中,12个可以被先前的研究所证实,20个靶点为本研究的新发现。
詹思延教授团队长期致力于药物流行病学与临床流行病学等相关研究,本研究成果为慢性肾脏病的靶向干预、多靶点联合治疗、免疫治疗以及新药研发等潜在的临床科研转化提供了证据支撑。
北京大学医学部博雅博士后司书成为该论文的第一作者,北京大学第三医院为第一完成单位,北京大学第三医院临床流行病学研究中心主任詹思延教授为该论文的通讯作者。本研究获得了国家自然科学基金、北京市自然科学基金、国家资助博士后研究人员计划等多个项目的资助。
原文链接:https://doi.org/10.1186/s13073-024-01356-x
第一作者

司书成
北京大学第三医院
临床流行病学研究中心博士后
助理研究员
主要研究方向:统计遗传学、药物流行病学
通讯作者

詹思延
北京大学第三医院
临床流行病学研究中心主任
教授、博士生导师
主要研究方向:药物流行病学、临床流行病学与循证医学等
参考文献
1. Si, S., Liu, H., Xu, L. et al. Identification of novel therapeutic targets for chronic kidney disease and kidney function by integrating multi-omics proteome with transcriptome. Genome Med 16, 84 (2024).
(北京大学第三医院)