
-

生物通官微
陪你抓住生命科技
跳动的脉搏
林圣彩院士课题组揭示机体碳源利用转换的新机制
【字体: 大 中 小 】 时间:2024年06月21日 来源:厦门大学生命科学学院
编辑推荐:
图1 饥饿条件下,谷氨酰胺作为替代碳源参与代谢(TCA:三羧酸循环;BCAA:支链氨基酸;GNG:糖异生;OAA:草酰乙酸;Pyr:丙酮酸)6月19日,林圣彩课题组在Cell Research杂志发表了题为“AMPK targets PDZD8 to trigger carbon source shift from glucose to glutamine”的文章,阐述了促进谷氨酰胺代谢的机制
葡萄糖、脂肪酸和氨基酸是生物体的三大碳源物质,是我们人体最重要也是最基本的物质与能量的来源,并调节了诸多生物学功能。然而,在日常生活中,三大碳源并非一直都很丰富,在许多条件下,例如在餐后数小时后或进餐之前,血糖以及组织中的葡萄糖水平都会显著地下降——这是十分常见的生理现象。尽管有糖原分解、糖异生等方式来补充葡萄糖,但这些过程至多保证机体血糖不会过低,从而防止出现低血糖等危及生命的状态,却不能完全阻止体内糖的短缺。因此,在面对血糖水平下降时,机体从主要利用葡萄糖到利用其它营养物的转变过程,就显得十分关键了。
从上世纪50年代起,以George F Cahill Jr等为代表的先驱们,逐步揭示了饥饿条件下,机体能够动员所储存的脂肪(如脂肪组织里的甘油三酯)和蛋白质(如肌肉里的肌纤维),并利用被动员的脂肪酸、氨基酸进入线粒体中的三羧酸循环而被氧化,来弥补葡萄糖短缺的现象,从而初步揭示了三大碳源物质之间,尤其是脂肪酸和氨基酸作为葡萄糖的替代碳源的利用与转化的规律。后续的研究进一步从分子水平揭示了以AMPK为代表的代谢稳态维持的核心蛋白,能够在葡萄糖水平下降的情况下,通过磷酸化脂肪酸合成的关键酶ACC(acetyl-CoA carboxylase),来抑制脂肪酸的合成,并促进更多的脂肪酸被氧化。而在氨基酸方面,AMPK能够抑制机体里另一个合成代谢的“主管”——mTORC1,阻止mTORC1所介导的蛋白质的合成,从而为机体保留更多的游离氨基酸以维持它们的氧化。除mTORC1以外,AMPK也能通过自噬作用以促进蛋白质的水解,从而产生更多的游离氨基酸。在游离氨基酸中,又以谷氨酰胺和丙氨酸最为关键,尤其是前者,不但是血液循环中最为丰富的氨基酸(在饥饿时占到了体内游离氨基酸的50%以上),同时也是机体动员、释放的氨基酸最终进入血液循环并被如肝脏等器官氧化利用之前所必需被转化成的氨基酸种类(例如,肌肉动员的支链氨基酸大部分通过转氨等途径转化为谷氨酰胺,再进入血液被利用),可谓是牵一发而动全身(图1)。然而,谷氨酰胺的氧化利用本身是如何被促进的,却一直不清楚。
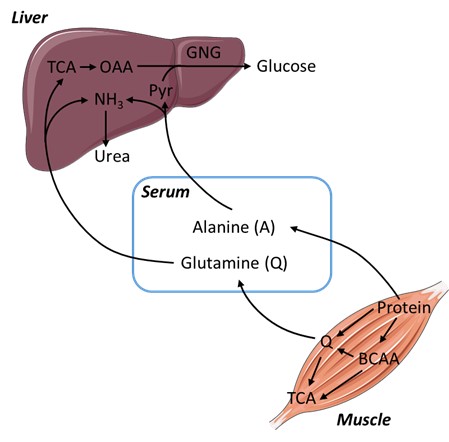
图1 饥饿条件下,谷氨酰胺作为替代碳源参与代谢
(TCA:三羧酸循环;BCAA:支链氨基酸;GNG:糖异生;OAA:草酰乙酸;Pyr:丙酮酸)
6月19日,林圣彩课题组在Cell Research杂志发表了题为“AMPK targets PDZD8 to trigger carbon source shift from glucose to glutamine”的文章,阐述了促进谷氨酰胺代谢的机制。他们发现,在低葡萄糖条件下,AMPK能够通过磷酸化一个新底物——PDZD8(PDZ domain-containing protein 8),促进机体对谷氨酰胺这一关键氨基酸的氧化利用。从而“补全”了AMPK促进氨基酸作为葡萄糖的一类替代碳源的机制的拼图。
林圣彩课题组长期以来致力于营养物质的感知与AMPK的激活机制的研究,他们先前发现了细胞感知葡萄糖水平下降,并激活AMPK的溶酶体通路,也发现了该通路如何与其它通路协作,介导在低葡萄糖条件下mTORC1的抑制的机制。在此基础上,他们开始在体内、在动物水平上,分析机体对氨基酸和脂肪酸的利用。他们选择了通过稳定同位素标记的谷氨酰胺和棕榈酸(是用于检测脂肪酸氧化的代表之一)来进行实验,借此仔细地跟踪了不同的饥饿时长下,谷氨酰胺和棕榈酸的利用。他们惊奇地发现,小鼠饥饿时,机体对谷氨酰胺的利用显著早于棕榈酸,表现在饥饿8小时亦即血糖刚下降不久时,标记的谷氨酰胺进入线粒体和三羧酸循环并被氧化的量就明显增多,而棕榈酸氧化的增多则需要在饥饿12小时以上才能被观察到。这一现象也存在于体外培养的细胞中。重要的是,不仅仅是棕榈酸的氧化的增加需要通过AMPK来介导,谷氨酰胺氧化增加的本身也是完全依赖于AMPK的,这说明,AMPK能够通过一种未知的机制,促进谷氨酰胺的氧化。
作者们于是尝试解析这一机制。他们回忆起了2019年发表在Cell Research(https://doi.org/10.1038/s41422-019-0163-6)的文章,在这篇文章中他们报道了一个现象:葡萄糖水平下降以后的细胞中的线粒体更倾向于结合在内质网上,形成更多的MAM(mitochondria-associated membranes)结构,这表现在直接通过亚细胞分离(subcellular fractionation)的方法对细胞的膜结构进行纯化,所得到MAM组分,或者说MAM的“产量”明显增加,而不和内质网相互作用的、纯的线粒体的产量则显著降低。鉴于MAM对于线粒体的活力十分重要,作者们进一步对该现象进行了分析,发现低糖条件下,MAM组分的增加是依赖于AMPK的,并通过进一步用特异性地识别AMPK的磷酸化底物的抗体进行分析,确定了MAM组分中含有AMPK的底物。在此基础上,通过用此抗体对AMPK的底物进行富集,并辅助以蛋白质谱进行鉴定,他们发现了12个定位在MAM的,在低糖时被磷酸化的蛋白质。其中有3个——PDZD8、RMDN3和PDHA1,被进一步验证为AMPK的底物(其中PDHA1已被报道为AMPK的底物)。通过分别敲除这三个基因,他们发现仅有PDZD8的敲除,能够阻止低糖所促进的谷氨酰胺氧化。进一步的探究发现了PDZD8被AMPK磷酸化的位点是其第527位的苏氨酸(T527),且在PDZD8敲除的细胞或者小鼠的肌肉中回补PDZD8-T527A突变体、阻断了AMPK对PDZD8的磷酸化以后,能够起到类似于PDZD8敲除以后的、阻止低糖所促进的谷氨酰胺氧化的作用。作者们还发现,PDZD8-T527A既不会反过来影响AMPK的激活,也不会影响AMPK对脂肪酸氧化的促进,这说明PDZD8是一个类比于ACC的、专门负责谷氨酰胺氧化这一功能的、AMPK的底物。
作者还探究了PDZD8被AMPK磷酸化后,促进谷氨酰胺利用的机制。他们发现,在葡萄糖饥饿的细胞中,谷氨酰胺氧化的限速酶GLS1(glutaminase 1)的活力明显提高,并且高度依赖于AMPK对PDZD8的磷酸化。进一步的研究表明,AMPK对PDZD8的磷酸化能够促进后者的变构,使之加强与GLS1的相互作用,而这一相互作用显著地促进了GLS1的活力。在体外,把已经被AMPK磷酸化过的PDZD8蛋白与GLS1蛋白直接混合,就能够提升GLS1的活力。而突变了能够介导PDZD8与GLS1相互作用的氨基酸,就如同PDZD8-T527A一样,失去了激活GLS1乃至于饥饿时所加强的谷氨酰胺利用的作用。由此,作者们解析出了一条AMPK-PDZD8-GLS1的通路,通过该通路,机体能够在缺乏葡萄糖的条件下,动用谷氨酰胺以弥补葡萄糖缺乏所造成的影响(图2)。
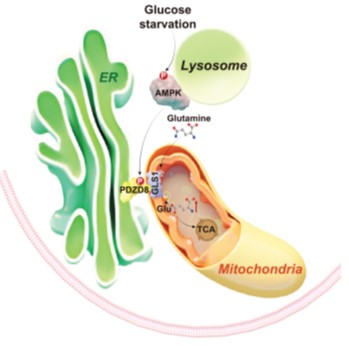
图2 AMPK通过PDZD8,促进GLS1和谷氨酰胺的代谢
作者们还将AMPK-PDZD8-GLS1促进谷氨酰胺代谢的通路与AMPK-ACC促进脂肪氧化的通路进行了比较,对后者动用脂肪酸的速度比前者动用谷氨酰胺的速度更加迟缓的现象做出了初步的解释。与AMPK-PDZD8-GLS1直接作用于线粒体的谷氨酰胺氧化不同,AMPK-ACC对脂肪酸氧化的促进是间接的:需要AMPK磷酸化并抑制ACC足够长的时间才能使得ACC的产物malonyl-CoA的水平下降到一定的水平,才能解除malonyl-CoA对线粒体脂肪酸氧化的抑制作用,才能够提升脂肪酸氧化的水平。而这一点在低糖条件下,溶酶体通路所介导的AMPK激活中更甚:此时AMPK的激活具有很强的区域性(集中在溶酶体上),且只能磷酸化并抑制定位在细胞质里的ACC1亚型,通过细胞质内整体的malonyl-CoA水平的缓慢下降,传导到线粒体附近,最终促进脂肪酸的氧化。相比之下,如果通过使用激动剂无差别地激活胞内所有的AMPK,并在ACC1的基础上,同时引起定位在线粒体表面的ACC2的磷酸化,就能够通过局部地降低线粒体附近的malonyl-CoA,大大加快脂肪酸氧化的速度,使之被提升的时间点提前到和谷氨酰胺差不多的程度。当然,优先利用谷氨酰胺本身可能还有其它的生理意义,如分解损坏和剩余的蛋白质可能是组织更新的重要一环,而脂肪则是为长期饥饿而储备的。
最后,作者还探究了AMPK-PDZD8-GLS1通路的生物学功能。有意思的是,该通路的缺乏并不影响低糖时细胞ATP的水平,这说明缺糖早期,细胞能够通过AMPK抑制蛋白合成等耗能的代谢途径,即使在没有谷氨酰胺氧化加强的条件下,有效地维持ATP的水平,直到缺糖后期脂肪酸氧化供能的加强。这也进一步暗示了谷氨酰胺氧化的加强可能有独特的生物学意义。作者们于是选择了LPS(lipopolysaccharides)所模拟的细菌急性感染的条件——该条件能够显著地降低血糖,且GLS1和谷氨酰胺的利用已被证明对于机体响应LPS,启动免疫反应至关重要。在致死剂量LPS处理的条件下,他们确实观察AMPK-PDZD8-GLS1 信号传递轴可以维持巨噬细胞对促炎因子的分泌,促进炎症反应的发生,并引起小鼠更严重的死亡。而在巨噬细胞中导入不能磷酸化的PDZD8-T527A突变体,则显著降低了机体针对LPS的炎症反应。尽管由于LPS的特殊性和急性炎症的特点,加强谷氨酰胺的利用反而加大了LPS的致死性——这和诸多感染条件下所发生的炎症反应所起到的保护作用相悖,但上述表型至少说明了AMPK-PDZD8-GLS1通路在低糖条件下的重要生理功能,对不同的临床患者是否添补谷氨酰胺的水平将会起到指导作用。该表型也进一步激发起我们在未来,对更长的时间尺度下的低糖和AMPK激活条件,如卡路里限制等条件下,谷氨酰胺代谢的重要功能的猜想与兴趣。
总之,林圣彩课题组的发现解决了碳源代谢与调控方面的又一生物学重大机制,这一发现对我们认识机体维持代谢稳态与能量平衡,乃至未来对代谢紊乱的控制与“纠偏”,具有重要的启发意义。
该研究获得了科技部、基金委、福建省卫健委和厦门大学的多个基金项目的支持。河南大学基础医学院的王永亮老师为同位素标记与代谢流示踪提供了重要的技术支持,厦门大学生命科学学院李勤喜和江彬老师为GLS1活力的测量提供了重要的指导,韩家淮和吴剑锋老师指导并进行了炎症相关实验的分析,生物医学仪器共享平台的祝明霞、章赐雄、谢昌传、吴雅颖、徐哲妮、姚路明等多位老师为本项目所运用的代谢、蛋白质谱等实验手段贡献了重要的力量。
文章链接:https://doi.org/10.1038/s41422-024-00985-6
(图/文 林圣彩院士课题组)