
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道CXCR6+ILC3s迁移到肾脏并通过表达PD-1增强IL-23R信号传导加剧肾纤维化
【字体: 大 中 小 】 时间:2024年06月15日 来源:国家自然科学基金委员会
编辑推荐:
研究成果以“肠道CXCR6+ILC3s迁移到肾脏并通过表达PD-1增强IL-23R信号传导加剧肾纤维化(Intestinal CXCR6+ ILC3s Migrate to the Kidney and Exacerbate Renal Fibrosis via IL-23 Receptor Signaling Enhanced by PD-1 Expression)”为题,2024年5月29日在线发表于《免疫》(Immunity)杂志上,论文链接https://www.cell.com/immunity/abstract/S1074-7613(24)00255-3
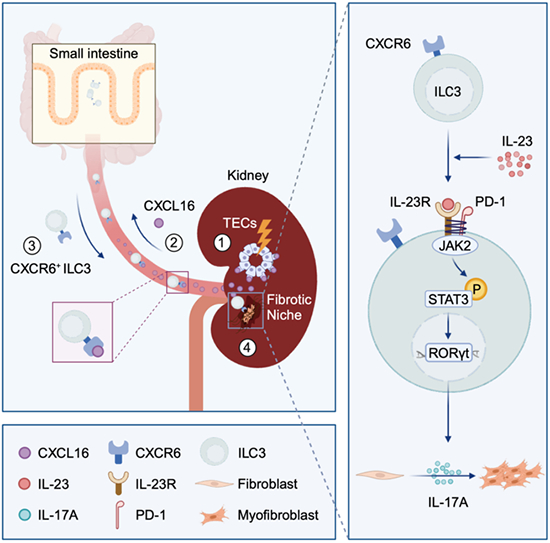 |
图 ILC3s肠-肾迁移在肾脏纤维化中的关键作用 在国家自然科学基金项目(批准号:82022009、82270764、82370707、82170737)等资助下,中山大学周怡教授、陈崴教授团队与海外合作者在肾脏损伤修复的免疫调控机制研究方面取得新进展。研究成果以“肠道CXCR6+ILC3s迁移到肾脏并通过表达PD-1增强IL-23R信号传导加剧肾纤维化(Intestinal CXCR6+ ILC3s Migrate to the Kidney and Exacerbate Renal Fibrosis via IL-23 Receptor Signaling Enhanced by PD-1 Expression)”为题,2024年5月29日在线发表于《免疫》(Immunity)杂志上,论文链接https://www.cell.com/immunity/abstract/S1074-7613(24)00255-3。 肾脏纤维化是各种慢性肾脏病(CKD)进展至终末期肾脏病(ESKD)的共同通路和最终病理结局,过度炎症反应是其启动环节。深入探讨肾脏损伤后免疫炎症反应对临床防治肾脏纤维化、延缓CKD进展具有重要意义。肠道作为人体最大的免疫器官,被越来越深入地认识到与肾脏疾病之间存在密切关联,然而“肠-肾轴”的免疫调控机制仍不清楚。 研究团队通过分析CKD患者发现,三型固有淋巴细胞(ILC3s)在肾组织和外周血中显著增加,且与肾脏纤维化严重程度以及肾功能丢失密切相关。进一步利用多种肾脏纤维化小鼠模型,发现在肾脏损伤后,肠道中富集的CXCR6+ILC3s迅速动员,并在CXCR6/CXCL16趋化轴介导下迁移至肾脏,然后ILC3s通过上调表达PD-1,放大细胞内JAK2/STAT3/RORγt信号,产生大量促纤维化细胞因子IL-17A,最终促进纤维灶的形成和加重肾脏纤维化(图)。 该研究报道了ILC3s肠-肾迁移在肾脏纤维化进展中的关键作用,为肾脏损伤修复的免疫调控机制和治疗策略提供新的理论基础和实验依据,并为肾脏纤维化的肠道干预策略提供新的思路。