
-

生物通官微
陪你抓住生命科技
跳动的脉搏
《自然-医学》重磅发表沈琳教授团队最新成果:CLDN18.2 CAR-T细胞治疗晚期消化道肿瘤的I期研究全人群结果
【字体: 大 中 小 】 时间:2024年06月08日 来源:北京大学医学部
编辑推荐:
2024年6月3日,沈琳教授团队在国际权威学术期刊《自然-医学》(Nature Medicine)在线发表题为“Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial final results”研究成果,并由第一作者齐长松教授同步在2024年美国临床肿瘤学会(ASCO)进行大会口头报告
2024年6月3日,沈琳教授团队在国际权威学术期刊《自然-医学》(Nature Medicine)在线发表题为“Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial final results”研究成果,并由第一作者齐长松教授同步在2024年美国临床肿瘤学会(ASCO)进行大会口头报告。该研究全面报道了靶向Claudin18.2(CLDN18.2)CAR-T在消化系统肿瘤中的疗效和安全性,是当今全球针对CLDN18.2靶点的实体瘤细胞免疫治疗的最大样本研究,具有里程碑式意义!

CAR-T细胞疗法已经在血液系统恶性肿瘤领域全面开花,因此如何克服实体瘤已成为CAR-T细胞治疗的首要挑战。CT041/Satricabtagene autoleucel (satri-cel)是一种特异性靶向CLDN18.2的CAR-T细胞疗法,沈琳教授团队已在2022年6月发表了CT041-CG4006研究的中期分析报道(Qi, C. et al. Nat. Med. 2022. doi: 10.1038/s41591-022-01800-8),初步展示了CT041/satri-cel的安全性和有效性,尤其是对于胃/胃食管结合部腺癌(GC/GEJ)的疗效,引起了广泛关注。现如今,经过长期的安全性观察和生存随访,如期发表针对该研究全人群的最新研究结果。
本研究是一项单中心、开放标签、单臂I期研究。研究人群是CLDN18.2阳性(定义为≥40%的肿瘤细胞的膜染色强度≥2+)的晚期消化道肿瘤。研究的主要终点是首次输注CT041/satri-cel后4周的安全性和耐受性。次要终点是CT041/satri-cel的细胞代谢动力学、12个月的安全性和耐受性以及抗肿瘤疗效。
从2019年3月26日至2022年1月21日,98例患者接受了至少一次CT041/satri-cel输注。15例患者参加了剂量爬坡阶段,在剂量扩展阶段(n=83),分别开展了4个研究队列。队列1,纳入标准治疗失败的消化道肿瘤患者接受CT041/satri-cel单药治疗(n=61);队列2,纳入标准治疗失败的消化道肿瘤患者接受CT041/satri-cel联合PD-1单抗(特瑞普利单抗)治疗(n=15);队列3,在GC/GEJ患者一线治疗后未进展的情况下,将CT041/satri-cel作为序贯治疗(n=5);以及队列4,既往CLDN18.2单抗治疗失败的 GC/GEJ患者接受CT041/satri-cel单药治疗(n=2)。98例患者中,73例为GC/GEJ,10例胰腺癌,8例肠癌(结肠癌及小肠癌),4例胆道系统肿瘤及3例其他瘤种。
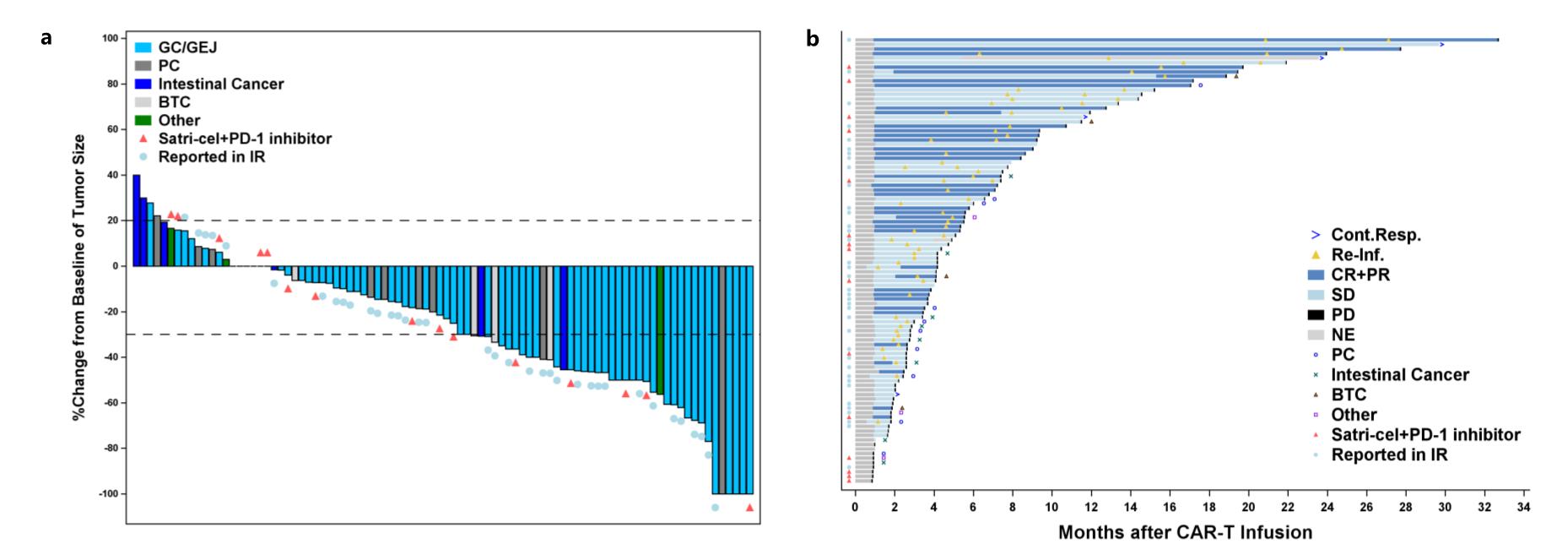
图示:CT041/satri-cel治疗后疗效瀑布图(a)及泳道图(b)
截止2024年1月26日,自首次输注CT041/satri-cel以来的中位随访时间为32.4个月。在98例患者中,90例患者具有靶病灶,其中70例患者出现肿瘤消退。总缓解率(ORR)为42.2%,疾病控制率(DCR)为91.1%。在队列3的4例患者中,ORR和DCR均为100%,中位无进展生存时间(mPFS)和中位总生存时间(mOS)分别为15.2个月和16.4个月。在既往CLDN18.2单抗治疗失败的2例患者中(队列4),1例患者获得部分缓解(PR),1例患者疾病稳定(SD)。
在接受CT041/satri-cel单药治疗的GC/GEJ患者中(n=59),51例患者具有靶病灶,ORR和DCR分别为54.9%(28/51)和96.1%(49/51),中位反应持续时间(mDOR)为6.4个月。59例患者的mPFS和mOS分别为5.8个月和9.0个月。
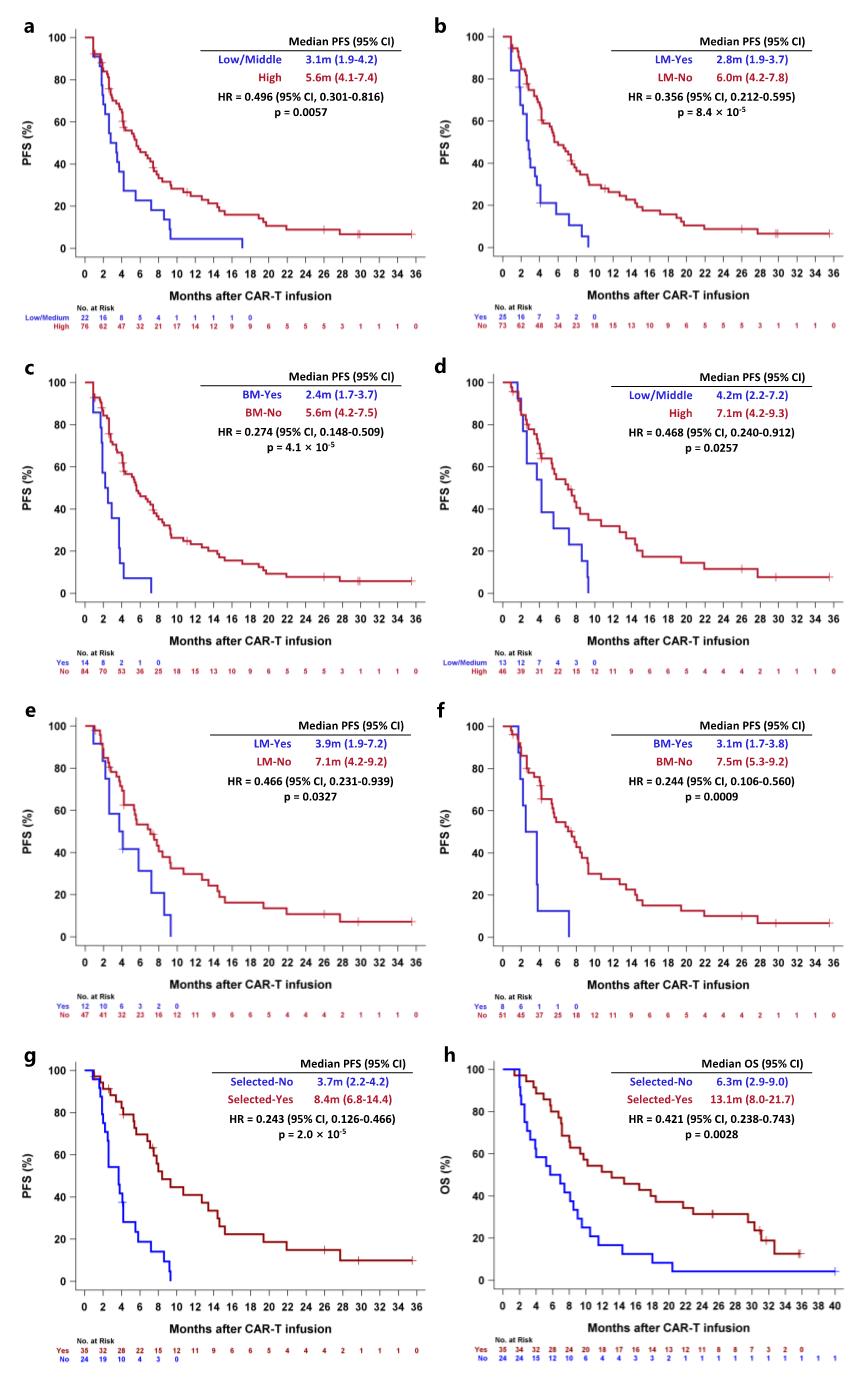
图示:接受CT041/satri-cel单药治疗的GC/GEJ患者中,不同亚组分析的生存曲线
进一步亚组分析表明,在接受CT041/satri-cel单药治疗的GC/GEJ患者中,CLDN18.2高表达(≥70%的肿瘤细胞的膜染色强度≥2+)患者的mPFS优于低/中表达患者(7.1 vs 4.2个月,P=0.00257);在肝转移(3.9 vs 7.1个月,P=0.0327)和骨转移(3.1 vs 7.5个月,P=0.0009)患者中分别观察到mPFS明显缩短。对于没有肝和骨转移的CLDN18.2高表达人群,展现出更显著的mPFS (8.4 vs 3.7个月,P=0.00×10?5)和mOS (13.1 vs 6.3个月, P=0.0028)优越性。
同时,考虑到胃肠道肿瘤的快速侵袭性,以及CAR T细胞的制备时间可能会错失患者的最佳治疗时间窗,我们还探讨了在一线治疗期间“提前单采”的可行性和临床价值,这一设定使得患者在对标准治疗失败后即可立即接受清淋和CT041/satri-cel输注,为患者争取最佳的治疗时机。共有15例患者在一线治疗期间接受提前单采。在接受单药治疗的GC/GEJ癌症患者中,与常规单采人群(n=48)相比,提前单采人群中的mPFS(7.1 vs 5.5个月,P=0.8912)和mOS(10.2 vs 8.8个月,P=0.6683)在数值上相对更长。
安全性方面,首次输注后28天内未观察到剂量限制毒性(DLT),也未观察到远期并发症。在98例人群中观察到的安全性数据与中期报告基本一致。CRS发生率96.9%,且均为1-2级。未观察到免疫效应细胞相关神经毒性综合征(ICANS)、噬血细胞性淋巴组织细胞增多症(HLH)或治疗相关死亡。8.2%患者出现胃粘膜损伤,考虑为中靶脱瘤毒性。
综上,基于CT041-CG4006研究的全人群分析,CT041/satri-cel细胞治疗在晚期消化道肿瘤患者中展现出良好的安全性和显著的疗效前景。目前由沈琳教授牵头的CT041/satri-cel在三线及以上胃癌患者的II期确证性随机对照研究也已逐步进入尾声,期待更进一步的循证医学结果,为更多患者带来福音。
该研究由北京大学肿瘤医院消化肿瘤内科及I期临床病区共同主导,郑州大学第一附属医院肿瘤科参与了本项研究。齐长松、刘畅、龚继芳为论文共同第一作者,齐长松、李健、张小田、沈琳教授为论文通讯作者。
(北京大学肿瘤医院)