
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命科学学院杜鹏课题组通过剪接抑制获得两种新型人全能性干细胞
【字体: 大 中 小 】 时间:2024年06月07日 来源:北京大学新闻网
编辑推荐:
2024年6月5日,杜鹏课题组在Cell杂志在线发表研究论文。在这项研究中,作者通过抑制剪接体重编程人多能性干细胞,成功捕获了两种人全能性状态的细胞。第一种细胞是区别于8CLC的独特ZGA-like细胞ZLCs(ZGA-like cells),该细胞随后可以转变成为具有pre-ZGA特征的hTBLCs(human totipotent blastomere-lik...
受精后,合子基因组最初处于沉默状态,前几轮细胞分裂主要依赖母源因子。在人类胚胎8细胞阶段,合子基因组激活(ZGA,zygotic genome activation),使得胚胎发育逐渐转变为合子基因组调控。合子和早期胚胎卵裂球被称为全能性细胞,具有最高的发育潜能,能够形成一个完整生物个体,包括胚内外的所有组织。然而,如何在体外捕捉并维持人全能性干细胞,该问题仍未被解决。
近年来,两个研究小组已经成功使用化学小分子混合物培养了具有胚内和胚外发育潜能的鼠和人扩展型多能干细胞(Expanded/extended pluripotent stem cell,EPSC)1,2。这些细胞不表达典型的全能性相关基因,而是持续表达多能性基因。在分子特征和功能上与真正的全能性干细胞相比仍有一定的差距。
2021年,北京大学生命科学学院/北大-清华生命科学联合中心/北京大学核糖核酸北京研究中心的杜鹏教授课题组通过抑制剪接体,首次成功捕获并稳定培养了小鼠全能性干细胞(mouse totipotent blastomere-like cells,mTBLCs)3。这些细胞在单细胞转录组、翻译组、DNA甲基化组和染色质可及性方面展示了与体内2-4细胞全能性胚胎相似的分子特征。在体内外分化体系中显示出强大的双向发育潜能,能够产生胚内和胚外组织。此后,其他几个研究团队通过不同化学小分子组合成功分离了其他类型的小鼠全能性干细胞,包括totipotent potential stem cells(TPSCs)、totipotent-like stem cells(TLSCs)和chemically induced totipotent stem cells(ciTotiSCs)4-6。
2022年,多个研究小组报导在5iLA或4CL等培养条件下,从人原始态多能干细胞(na?ve hESCs)中成功捕获了一种新型的8细胞样细胞(8CLCs)7,8。这些细胞存在的比例极低(0.2—2%),并且高表达经典的ZGA标志基因,如ZSCAN4和DUXA。然而,8CLCs并不稳定,无法在体外多次传代。目前,具有最高发育潜能的人全能性细胞仍无法在体外稳定培养。
2024年6月5日,杜鹏课题组在Cell杂志在线发表了题为“Capturing Totipotency in Human Cells Through Spliceosome Repression”的研究论文。在这项研究中,作者通过抑制剪接体重编程人多能性干细胞,成功捕获了两种人全能性状态的细胞。第一种细胞是区别于8CLC的独特ZGA-like细胞ZLCs(ZGA-like cells),该细胞随后可以转变成为具有pre-ZGA特征的hTBLCs(human totipotent blastomere-like cells),并且能够在体外稳定培养。
论文截图
在本研究工作中,作者主要有以下发现:
1. 剪接体瞬时抑制将人多能性干细胞重编程为独特的ZGA-like细胞(ZLCs)
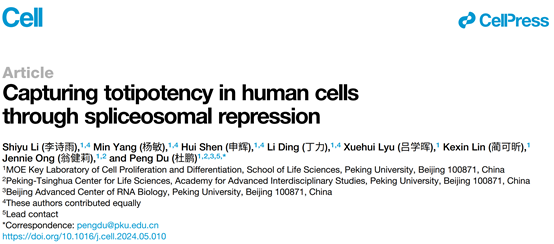
作者使用高浓度的剪接抑制剂Pladienolide B(PlaB)处理人始发态多能干细胞(primed hESCs)。转录组分析显示,在PlaB处理48h后,囊胚时期特异表达的基因显著下调,包括多个经典的primed基因,如PODXL、DNMT3B、THY1等。同时,8细胞时期特有的基因,如GADD45A/B,MED26,SNAI1等得到显著激活。细胞整体转录组与体内的ZGA时期8细胞胚胎/桑椹胚高度相似。此外,剪接因子SNRPD2的敲低实验进一步验证了剪接体抑制能够激活ZGA基因并沉默多能性基因。这种类ZGA细胞被命名为ZLCs(ZGA-like cells)。
通过对8CLCs和ZLCs进行转录组比较,发现ZLC的转录组与已知的8CLC显著不同。这两种细胞类型都富集一组8细胞/桑椹胚特异性基因(common ZGA genes),如 HIST1H2BG/BK 、 GADD45A/B 和 GPATCH3 。然而,与8CLCs不同,ZLCs并不表达典型的ZGA基因如DUXA/B、ZSCAN4/5B、LEUTX和TPRX1(8CLC ZGA genes),反而表达了一组在8CLCs中不激活的8细胞/桑椹胚特异性基因(ZLC ZGA genes),如ZNF23/34、FAM32A、HBEGF和MED26。更重要的是,ZLCs沉默了多数典型的na?ve多能性基因,包括DNMT3L、TBX3、GPX2和ALPP,而这些基因在8CLCs中仍激活。进一步的单细胞转录组分析显示,ZLCs在单细胞水平上广泛且均一的激活了ZGA基因,并沉默了多能性基因,其转录组接近体内8细胞时期胚胎,区别于其他已知的hESCs或8CLCs(图1)。

图1. 剪接体瞬时抑制策略捕捉到一种新型的模拟人体内8细胞胚胎的ZGA-like细胞,该细胞不同于已报道的8CLCs
2. 剪接体持续抑制使多能性干细胞转变为ZLC-like的中间状态,进而转变为具有pre-ZGA特征的,能够稳定传代的人全能干细胞(hTBLC)
由于高浓度PlaB短暂诱导的ZLCs无法长期维持,并会在几天内迅速死亡,作者开发了一种新型MYCP培养基,其中包含低浓度的PlaB,不仅能够稳定地培养细胞,且细胞保持着正常的核型,增殖速率以及细胞活率。有趣的是,转录组分析显示,在P3/P4阶段,common ZGA和ZLC ZGA基因被特异激活随后被迅速沉默。这些基因同时也在8细胞/桑葚胚以及高浓度PlaB诱导的ZLCs中激活,这意味着hESC在MYCP培养基中经历了一个ZLC-like的中间状态。大约在P10后,细胞整体转录组趋于稳定。与hESCs相比,这些细胞激活了一系列在合子和2-4细胞胚胎中特异富集的pre-ZGA基因如PLAGL1、ZNF337、SLC6A16、ZEB1、RFX4和ZBTB16,并且广泛沉默多能性基因。这种能够稳定培养的细胞被命名为hTBLCs(human totipotent blastomere-like cells)(图2)。
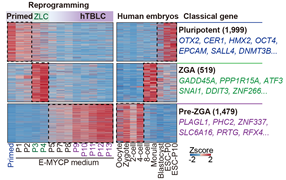
图2. 剪接体持续抑制使多能性干细胞转变为ZLC-like的中间状态,进而转变为具有pre-ZGA特征的hTBLC
作者进一步对hTBLCs与之前报道的na?ve/primed hESCs, hEPSC和8CLCs在转录组层面进行了系统比较。区别于所有已知的多种细胞,hTBLCs在转录组水平上具有独特的pre-ZGA特征,特异激活在合子和2-4细胞胚胎特异表达的基因以及转座子,并且广泛的沉默多能性基因。此外,通过CHIP-seq以及ATAC-seq在组蛋白修饰以及染色质可及性水平鉴定了hTBLC的表观特征,发现hTBLCs的H3K27me3修饰水平显著降低,与体内早期胚胎H3K27me3的全局擦除相一致。通过系统比较表观基因组信号峰值,相较于hESCs,在hTBLCs中超过一半的增强以及减弱的峰与体内2-4细胞时期胚胎显示出相似的状态。综上,通过使用转录组测序以及多组学分析,作者揭示了hTBLCs在转录组和表观组水平上与体内早期胚胎相近的分子特征(图3)。
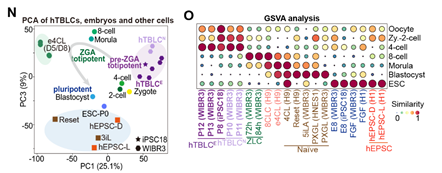
图3. 与已知的各种细胞不同,hTBLCs在转录组水平上具有独特的pre-ZGA特征
3. 基于hTBLCs的自发分化体系能够模拟人着床前胚胎发育
基于稳定培养的hTBLCs,作者开发了一种无需额外细胞信号操控的自发分化体系。在此体系中,hTBLCs被接种在primed hESC培养基中。转录组分析显示,pre-ZGA特异基因迅速沉默,细胞退出pre-ZGA状态。4h后, 如 DIO3 、 PPP1R15A 、 MED26 和 GADD45A 等common ZGA和ZLC ZGA基因被瞬时激活,而8CLC ZGA基因并不表达。作者指出,在自发分化体系的4h-16h阶段,细胞重新进入了一个ZLC-like的中间阶段,与重编程过程中P3/P4的ZLC-like中间态以及高浓度PlaB瞬时诱导的ZLCs相似,且明显区别于8CLCs(图4)。
在随后的24-72h分化过程中,细胞并行地产生了胚内谱系上胚层EPI(epiblast),和胚外谱系原始内胚层PrE(primitive endoderm)和滋养层TE(trophectoderm)。72h后,包括OCT4,NANOG,DNMT3B等经典多能性基因稳定表达,标志着细胞最终回到了primed状态。作为对照,在相同条件下,na?ve hESCs无法产生胚外细胞谱系(图4)。综上,在没有外部细胞信号操控的条件下,hTBLCs自发分化过程中,细胞首先经过一个ZLC-like中间状态,随后经历两次细胞命运决定,生成EPI-like、TE-like和PrE-like的胚内外细胞谱系。这个自发分化体系不仅有力证明了hTBLCs具有独有的pre-ZGA全能性,这是多能性细胞所不具备的,同时提供了一个用于模拟人胚胎着床前发育过程的体外分化体系。
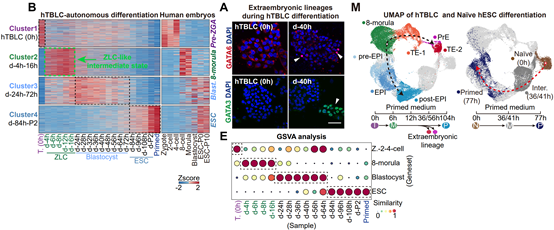
图4. 基于hTBLCs的自发分化体系能够模拟人着床前胚胎发育
4. hTBLCs能够在人胚胎培养基中产生类囊胚
近几年来,研究人员通过使用na?ve/primed多能干细胞以及hEPSCs在化学小分子的作用下成功构建了人类囊胚。在本研究中,与现有的类囊胚构建体系不同,作者仅使用人胚胎培养基G2-plus,在不添加任何小分子的条件下,成功利用hTBLCs生成了类囊胚结构(图5)。而na?ve hESCs和hEPSCs在相同条件下未能形成类囊胚结构。免疫染色分析显示hTBLCs类囊胚中CDX2+的TE-like细胞位于外层,OCT4+的ICM-like细胞聚集在内部,两种细胞之间形成明显的空腔。单细胞转录组分析进一步证明,由hTBLCs衍生的类囊胚主要由TE-like,PrE-like以及EPI-like三种细胞组成。单细胞整合分析显示,hTBLCs类囊胚中的三种细胞谱系能够与人类E5-E7阶段囊胚中的对应细胞谱系良好整合,这证明了hTBLCs能够形成与体内囊胚相近的类囊胚结构。
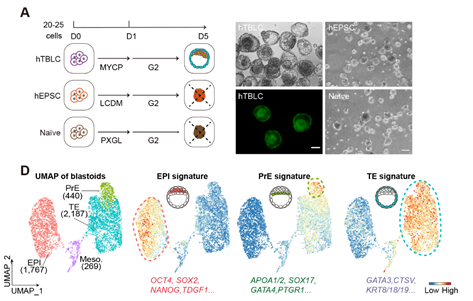
图5. hTBLCs能够在人胚胎培养基中,在不添加任何小分子的条件下产生类囊胚
5. hTBLCs在体内外分化体系中均展现出双向发育潜能
作者使用体内分化体系畸胎瘤形成和小鼠嵌合实验,以及体外分化体系拟胚体形成实验来验证hTBLCs的分化潜能。在拟胚体实验中,hTBLCs能够形成大小正常的拟胚体。在分化的第2—5天,hTBLCs特异激活了胚外细胞谱系PrE的特征基因,如GATA4/6,SOX17和COL4A1/2。在分化的第12—15天,hTBLCs展现出向内胚层肝细胞分化的偏好性。在畸胎瘤实验中,hTBLCs能够形成三胚层,并且分化出15种细胞类型。小鼠嵌合实验表明,在E4.5,E6.5以及E10.5嵌合胚胎中,均可以在胚内以及胚外组织中同时检测到hTBLCs的嵌合。这些分化实验结果证明hTBLCs不仅能够分化出三胚层中的多种功能性细胞,还能够产生胚外细胞谱系。
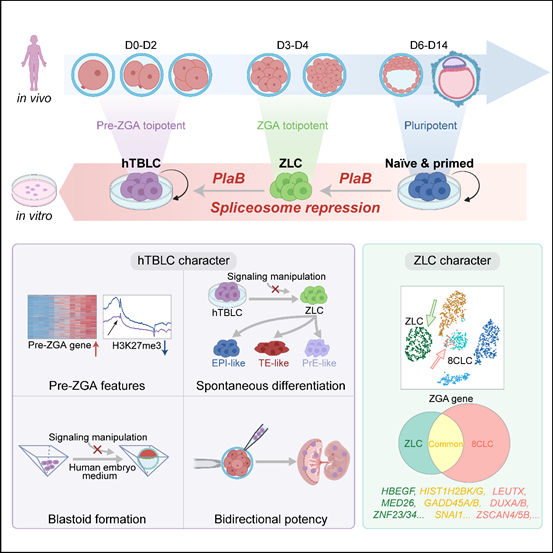
通过剪接抑制获得两种新型人全能性干细胞的模式图
综上,此项研究首次捕获了一种新型的ZGA-like细胞(ZLCs),并成功在体外稳定培养了具有pre-ZGA特征的人全能性干细胞(hTBLCs)。得益于其出色的分化潜能,hTBLCs作为体外分化体系中理想的“种子细胞”,能够产生高质量的功能细胞,未来能够广泛应用于类器官研究以及再生医学领域。此外,人和小鼠全能性干细胞的成功培养揭示了剪接抑制可能作为一种通用策略,推动多物种干细胞从多能性向全能性的转变。
杜鹏为该论文的通讯作者。北京大学生命科学学院博士后李诗雨、毕业博士生杨敏、博士后申辉、博士研究生丁力为本文的并列第一作者。北京大学生命科学学院博士后吕学晖、博士研究生蔺可昕、已出站博士后翁建莉对本文有重要贡献。该项工作得到了国家重点研发计划、国家自然科学基金、北京市自然科学基金的支持。
参考文献:
1.Yang, Y., Liu, B., Xu, J., Wang, J., Wu, J., Shi, C., Xu, Y., Dong, J., Wang, C., Lai, W. , et al. (2017). Derivation of Pluripotent Stem Cells with In Vivo Embryonic and Extraembryonic Potency. Cell 169 , 243—257 e225.
2.Gao, X., Nowak-Imialek, M., Chen, X., Chen, D., Herrmann, D., Ruan, D., Chen, A.C.H., Eckersley-Maslin, M.A., Ahmad, S., Lee, Y.L. , et al. (2019). Establishment of porcine and human expanded potential stem cells. Nat Cell Biol 21 , 687—699.
3.Shen, H., Yang, M., Li, S., Zhang, J., Peng, B., Wang, C., Chang, Z., Ong, J., and Du, P. (2021). Mouse totipotent stem cells captured and maintained through spliceosomal repression. Cell 184 , 2843—2859 e2820.
4.Yang, M., Yu, H., Yu, X., Liang, S., Hu, Y., Luo, Y., Izsvák, Z., Sun, C., and Wang, J. (2022). Chemical-induced chromatin remodeling reprograms mouse ESCs to totipotent-like stem cells. Cell Stem Cell 29 , 400—418.e413.
5.Xu, Y., Zhao, J., Ren, Y., Wang, X., Lyu, Y., Xie, B., Sun, Y., Yuan, X., Liu, H., Yang, W. , et al. (2022). Derivation of totipotent-like stem cells with blastocyst-like structure forming potential. Cell Res 32 , 513—529.
6.Hu, Y., Yang, Y., Tan, P., Zhang, Y., Han, M., Yu, J., Zhang, X., Jia, Z., Wang, D., Li, Y. , et al. (2022). Induction of mouse totipotent stem cells by a defined chemical cocktail. Nature.
7.Taubenschmid-Stowers, J., Rostovskaya, M., Santos, F., Ljung, S., Argelaguet, R., Krueger, F., Nichols, J., and Reik, W. (2022). 8C-like cells capture the human zygotic genome activation program in vitro. Cell Stem Cell 29 , 449—459 e446.
8.Yu, X., Liang, S., Chen, M., Yu, H., Li, R., Qu, Y., Kong, X., Guo, R., Zheng, R., Izsvák, Z. , et al. (2022). Recapitulating early human development with 8C-like cells. Cell Rep 39 , 110994.