
-

生物通官微
陪你抓住生命科技
跳动的脉搏
STTT | 陈宇研究组发现了冠状病毒2'-O-甲基转移酶通过改善底物结合影响病毒的致病性
【字体: 大 中 小 】 时间:2024年06月04日 来源:武汉大学病毒学国家重点实验室
编辑推荐:
近日,武汉大学病毒学国家重点实验室陈宇教授研究组在国际学术期刊Signal Transduction and Targeted Therapy在线发表了题为“Natural evidence of coronaviral 2'-O-methyltransferase activity affecting viral pathogenesis via improved substrate RNA binding”的研究论文
近日,武汉大学病毒学国家重点实验室陈宇教授研究组在国际学术期刊Signal Transduction and Targeted Therapy在线发表了题为“Natural evidence of coronaviral 2'-O-methyltransferase activity affecting viral pathogenesis via improved substrate RNA binding”的研究论文。该研究强调除了冠状病毒刺突蛋白外,对于病毒其他关键位点变异同样值得关注。这些关键残基的突变可能对病毒的致病力产生显著影响,进而改变病毒的传播和感染特性。因此,全面监测和评估这些突变对于疾病预防和控制至关重要。

先前大量研究通过靶向突变2'-O甲基转移酶的催化中心(K-D-K-E 基序),证明了2'-O-甲基转移酶活性对于病毒的高效复制和免疫逃避是必不可少的。然而,K-D-K-E催化基序在众多病毒中高度保守,包括黄病毒、痘苗病毒、冠状病毒,甚至延伸到哺乳动物。到目前为止,在自然界中还没有发现这些基序残基的自然变异。在这项研究中,研究人员发现SARS-CoV-2比SARS-CoV表现出更强的2'-O甲基转移酶活性,具体表现在具有更独特的帽序列特异性方式和更高的效率。通过系统性比较这两种病毒的nsp16/nsp10复合物的结构和功能特性,研究人员发现尽管这两种病毒2'-O甲基转移酶都具有一致的催化中心,但SARS-CoV-2的nsp16/nsp10复合物在RNA底物识别和结合方面表现出更高的灵活性和适应性;其中Leu-36, Asn-138和Ile-153残基被鉴定为两者差异的关键决定因素(图1)。
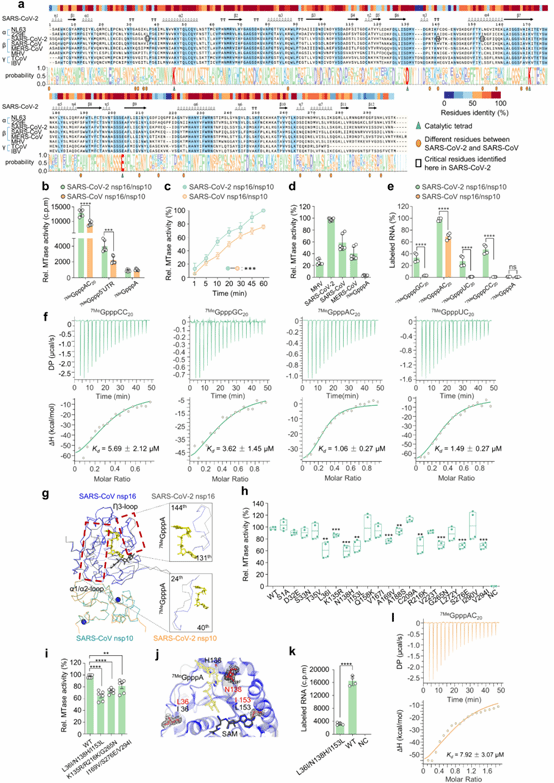
图1. SARS-CoV-2较强2'-O-甲基转移酶活性的生化和结构机制。
进一步地,研究人员利用BSL-II级安全复制子系统(具有转录和复制能力的SARS-CoV-2病毒样颗粒,trVLP-WT)将这些关键残基(从SARS-CoV-2到SARS-CoV的替换,Leu36→Ile36、Asn138→His138、Ile153→Leu153, trVLP-3Mut)引入SARS-CoV-2病毒(图2)。有趣的是,这种替代导致了病毒复制的显著减少,并伴有细胞培养物中I型干扰素(IFN-I)和促炎趋化因子的显著上调。这种诱导效应依赖于细胞质RNA传感器MDA5和LGP2的协同感应。
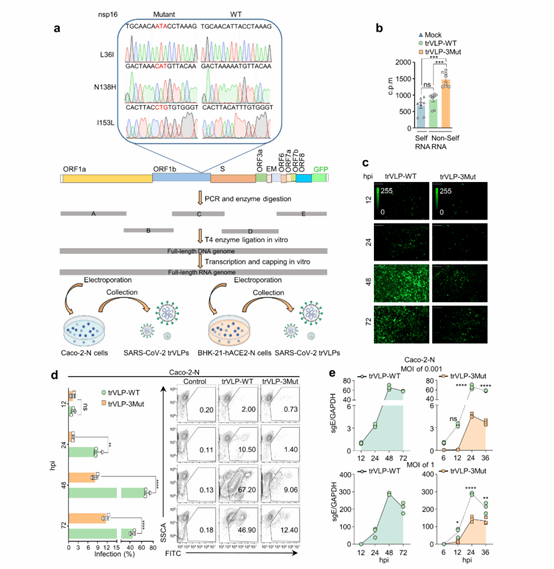
图2. nsp16 L36I/N138H/I153L突变体抑制SARS-CoV-2复制。
研究人员使用RNA-seq对感染的Caco-2细胞进行了无偏倚的转录组筛选,并与来自COVID-19患者肺泡灌洗液的转录组数据进行了比较分析,证实了trVLP-3Mut诱导宿主产生了更高的固有免疫应答。此外,研究人员利用慢病毒-N转导的方法建立了SARS-CoV-2 trVLPs感染K18-hACE2敲入(KI)小鼠模型,揭示了在小鼠体内一定比例上缺乏2'-O-甲基化修饰的重组SARS-CoV-2具有较差的复制效率和诱导更严重的疾病(图3)。这些发现表明nsp16残基的自然突变可能通过影响病毒的毒力和触发强大的炎症反应而带来潜在的风险。
图3 SARS-CoV-2 trVLPs感染K18-hACE2 KI小鼠基于慢病毒N转导。
总之,我们的研究结果表明,除K-D-K-E以外,2'-O-甲基转移酶的其他残基改变可能影响病毒复制,进而影响病毒致病性。监测nsp16残基的变化是至关重要的,因为它可能有助于识别和评估未来由nsp16的自然突变引起的冠状病毒致病性的变化。不同水平的2'-O-甲基化修饰对免疫和炎症反应有显著影响,因此确定2'-O-甲基化的最佳调控方式对于设计更高效、更低免疫原性的mRNA疫苗至关重要。此外,我们也为COVID-19和SARS的早期流行病学差异提出了一种可能的解释。
图4 冠状病毒2'-O-甲基转移酶活性通过增强底物RNA结合影响病毒致病性的示意图。
武汉大学病毒学国家重点实验室陈宇教授为该论文的通讯作者,博士研究生邓积凯、杨世敏和李颖健为该论文的共同第一作者。清华大学医学院丁强教授团队、武汉大学基础医学院范成鹏副教授以及病毒学国家重点实验室严欢教授和周立副教授给予了该研究大力支持。该研究得到了国家重点研发计划项目、国家自然科学基金和中央高校基本科研业务费专项资金等项目资助。
论文链接:https://www.nature.com/articles/s41392-024-01860-x