
-

生物通官微
陪你抓住生命科技
跳动的脉搏
上海交大李丹课题组与合作者揭示PET示踪剂PBB3识别TMEM106B蛋白聚集体的分子机制
【字体: 大 中 小 】 时间:2024年05月30日 来源:上海交大 新闻学术网
编辑推荐:
淀粉样蛋白纤维聚集体是多种神经退行性疾病(neurodegenerative diseases, NDs)的关键病理标志物和主要致病因素,如阿尔茨海默病中Tau蛋白形成的神经元纤维缠结(NFT)和β-淀粉样蛋白(Aβ)斑块。近年来,靶向结合NDs致病蛋白(如11C-PBB3结合Tau蛋白,11C-PiB结合Aβ)的正电子发射断层显像 (PET)的临床运用,不仅显...
淀粉样蛋白纤维聚集体是多种神经退行性疾病(neurodegenerative diseases, NDs)的关键病理标志物和主要致病因素,如阿尔茨海默病中Tau蛋白形成的神经元纤维缠结(NFT)和β-淀粉样蛋白(Aβ)斑块。近年来,靶向结合NDs致病蛋白(如11C-PBB3结合Tau蛋白,11C-PiB结合Aβ)的正电子发射断层显像 (PET)的临床运用,不仅显著提升了NDs的早期诊断水平,也推动了致病蛋白在ND患者脑中原位示踪的研究,极大地加速了人们对ND复杂发病机制和其致病蛋白靶向治疗的研究。
2022年初,上海交通大学Bio-X研究院李丹课题组,复旦大学附属华山医院王坚课题组与中国科学院生物与化学交叉中心刘聪课题组合作,首次在健康老年脑和PD脑中同时发现一种由跨膜蛋白106B(transmembrane protein 106B, TMEM106B)C末端片段折叠并组装形成的蛋白淀粉样聚集体,研究结果在Cell Research1上发表的同期,国外三个独立的研究团队也分别在Nature和Cell杂志上发表了类似的发现2-4。TMEM106B纤维聚集体广泛存在于健康老年脑和NDs脑的研究发现,一方面增加了现有NDs致病蛋白分子显像结果误判的风险,对NDs致病蛋白PET分子显像的选择性和特异性提出了全新的挑战;另一方面也带来了新的研究领域和机会——开发特异性更高的分子示踪剂,从而更准确地识别并区分不同类型的淀粉样蛋白,以进一步提高NDs的早期诊断精度。
2024年5月14日,上海交通大学李丹课题组与复旦大学附属华山医院王坚课题组合作在Cell Discovery杂志在线发表题为“A Tau PET tracer PBB3 binds to TMEM106B amyloid fibril in brain”的研究成果。本研究首次发现了Tau蛋白PET小分子示踪剂PBB3能够识别NDs脑中淀粉样蛋白纤维TMEM106B,并阐释其结合的分子机制。

本研究首先系统地表征了TMEM106B在101岁老年脑中的分布和形态,并通过免疫组化(IHC)和免疫荧光(IF)技术进一步确认TMEM106B的聚集体形式。研究发现,TMEM106B聚集体在大脑中主要呈现出两种形态:胞质内包涵体 (cytoplasmic inclusions) 和短丝状突起 (short filamentous processes)。通过硫磺素S染色进一步验证了TMEM106B的淀粉样聚集体特性。随后,人脑片原位IF染色实验发现临床运用的Tau PET显像剂PBB3能原位识别结合TMEM106B纤维聚集体,而Aβ PET显像剂PiB则不具备这种结合能力。
接下来,研究团队通过冷冻电子显微镜以及三维螺旋重构技术验证了上述原位脑片PET示踪剂与TMEM106B双染结果,并深入揭示了PBB3结合TMEM106B纤维聚集体的原子结构。研究团队成功纯化出同一病人、同一脑区中TMEM106B纤维,并将其分别与PBB3和PiB共孵育,随后进行结构解析。结果显示,PBB3能够与TMEM106B纤维蛋白的两个特定位点结合,而PiB并不与TMEM106B纤维蛋白结合。从冷冻电子显微镜的三维密度图上来看,PBB3在TMEM106B纤维蛋白表面形成了两个额外的密度,这些密度位于纤维蛋白表面的凹槽中,并与特定的氨基酸残基形成氢键。这些特征与PBB3衍生物在Tau纤维蛋白中的结合模式类似5,表明PBB3具有识别并结合不同淀粉样蛋白的潜力。PBB3在不同纤维蛋白中的结合模式表现出高度的一致性,表明其分子结构具有广泛的适应性,能够与多种淀粉样纤维蛋白相互作用。
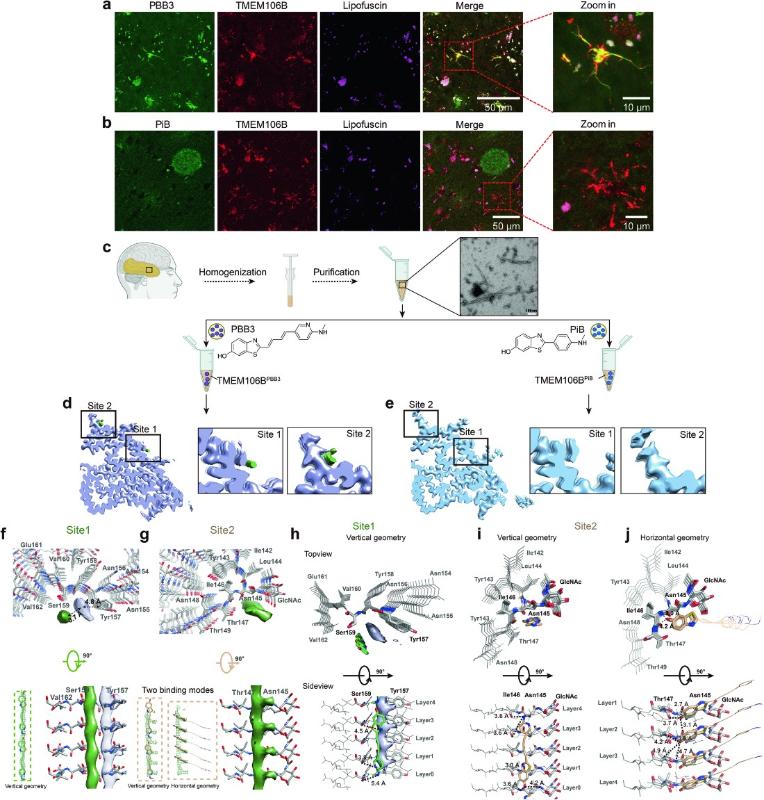
图示:PBB3在脑中识别TMEM106B淀粉样蛋白纤维及其互作的结构基础
该研究首次阐释了PBB3作为Tau示踪剂的潜在脱靶效应——不仅可结合人们熟知的Tau缠结,还可以识别全新的TMEM106B纤维蛋白。此发现提示科研人员及临床医师在NDs致病蛋白(如α-syn, Tau, Aβ和TDP-43)示踪剂的研发过程中,需要警惕其与广泛存在于老年脑及各种NDs脑中的TMEM106B纤维聚集体的脱靶结合。另外,通过原子水平的结构解析,研究团队明确了PBB3与TMEM106B纤维蛋白的结合机制,不仅提示PBB3可作为TMEM106B纤维蛋白示踪剂研发的分子骨架,也为未来开发高特异性TMEM106B显像剂奠定了重要的理论基础。TMEM106B纤维聚集体示踪剂的成功研发,将可视化活体人脑TMEM106B纤维蛋白分布模式与特征,进而揭示TMEM106B纤维蛋白在衰老和NDs中的复杂作用。总而言之,在前期研究创新性地发现人脑TMEM106B纤维聚集体并揭示其原子结构的基础上1,本研究进一步发现Tau PET示踪剂PBB3可与TMEM106B淀粉样蛋白纤维结合并揭示其机制,为NDs致病蛋白示踪剂研发的脱靶效应敲响了警钟,亦为人脑活体示踪全新TMEM106B纤维聚集体带来了曙光。
该研究由上海交通大学李丹课题组与复旦大学附属华山医院王坚课题组共同完成。上海交通大学李丹课题组研究生赵钦玥和复旦大学附属华山医院已毕业博士研究生范云为文章的共同第一作者,李丹教授和王坚教授为本文共同通讯作者。该工作受到了国家自然科学基金委,上海市科委和中国科学院等项目资助。
论文链接: https://www.nature.com/articles/s41421-024-00674-z
参考文献:
1. Fan Y, et al. Generic amyloid fibrillation of TMEM106B in patient with Parkinson's disease dementia and normal elders. Cell Res. doi: 10.1038/s41422-022-00665-3. (2022)
2. Schweighauser M, et al. Age-dependent formation of TMEM106B amyloid filaments in human brains. Nature. May;605(7909):310-314. doi: 10.1038/s41586-022-04650-z. (2022)
3. Jiang YX, et al. Amyloid fibrils in FTLD-TDP are composed of TMEM106B and not TDP-43. Nature. doi: 10.1038/s41586-022-04670-9. (2022)
4. Chang A, et al. Homotypic fibrillization of TMEM106B across diverse neurodegenerative diseases. Cell. doi: 10.1016/j.cell.2022.02.026. (2022)
5. Shi Y, et al. Cryo-EM structures of tau filaments from Alzheimer's disease with PET ligand APN-1607. Acta Neuropathol. doi: 10.1007/s00401-021-02294-3. (2021)