
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature|刘志博团队报道靶向共价放射性药物
【字体: 大 中 小 】 时间:2024年05月25日 来源:北京大学前沿交叉学科研究院
编辑推荐:
近日,北大-清华生命科学联合中心、北京大学化学与分子工程学院应用化学系刘志博团队于《自然》杂志在线发表了题为“Covalent Targeted Radioligands Potentiate Radionuclide Therapy”的研究论文,报.....
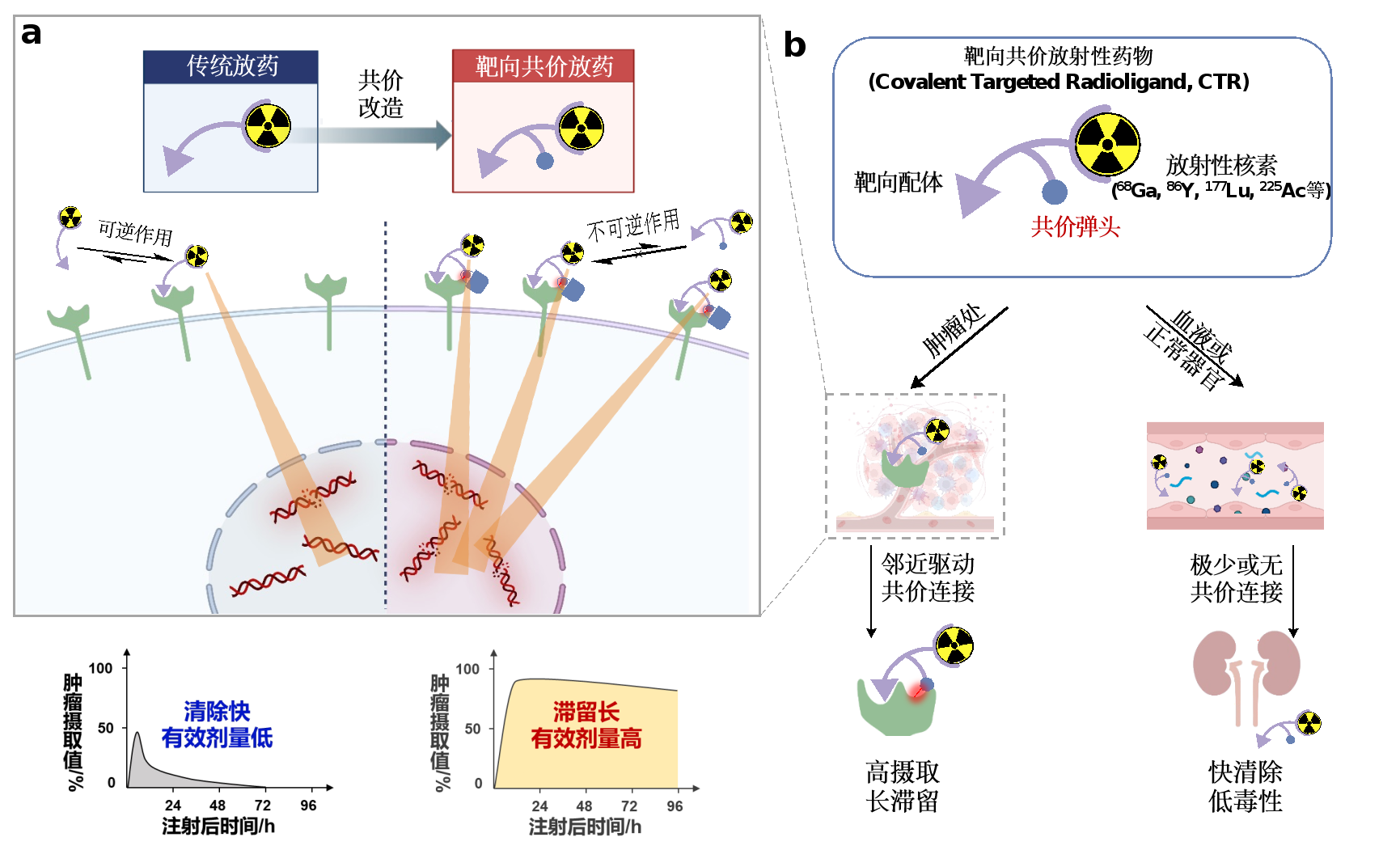
图1 靶向共价放射性药物工作原理及其优势
CTR在体内的工作模式如图1b所示。CTR可以是一个三功能配体,通过在适宜位置和取向上安装基于二代“点击化学”硫(Ⅵ)-氟交换反应(SuFEx)的“潜弹头”(latent warhead),实现配体在不损失亲和力的情况下对靶蛋白的共价连接,从而将携带核素的螯合剂不可逆地修饰到靶蛋白上。当CTR到达肿瘤时,先非共价地结合靶标,后通过邻近效应加速不可逆的共价连接,在加强亲和力的同时将肿瘤清除率降至最低。而其他未结合靶标的自由CTR则被快速排出体内。得益于“潜弹头”的相对生物正交性,CTR的脱靶共价连接有限,因此其系统毒性可被有效控制。值得一提的是,该研究首次报道了在人体中含SuFEx共价弹头分子的药代动力学研究,并验证了其在放射配体这一新兴药物形式上的匹配性。
1. CTR-FAPI不可逆地选择性共价连接FAP
对共价弹头的合理应用是CTR成功的关键因素之一。通过对FAP口袋残基的分析和共价对接,研究者在小鼠肿瘤模型中的初步研究发现:尽管在现有放射配体FAPI-04上安装磺酰氟弹头可提高肿瘤摄取,但存在由于弹头反应活性过高导致的稳定性问题。经弹头筛选,研究者采用放射自显影(Autoradioluminography)发现安装的氟代硫酸酯弹头不仅可在试管中实现超过80%的FAP共价结合,且在6天内几乎没有解离。进一步,研究者通过二级质谱分析,发现所设计CTR-FAPI分子的共价连接残基位点主要为Y210和Y450,并通过分子动力学模拟验证了其共价结合构象的合理性和稳定性。
关于共价药物的一个普遍担忧是难以预知的脱靶毒性。由于放射配体普遍具有高亲水性且包含多电荷螯合剂,大多数放射配体对细胞膜的被动渗透性有限,因此CTR对胞内蛋白的脱靶作用可能不是问题。研究人员主要考察了CTR-FAPI对FAP同源膜蛋白的选择性,发现其仍能保持104倍的高度FAP选择性。此外,在小鼠血浆和患者尿液中,CTR-FAPI也显示出极低的脱靶反应性。
2. CTR-FAPI展现更佳的PET成像对比度

图2 靶向共价放射性药物在动物模型中显示更高的肿瘤摄取
基于一系列分子实验和细胞验证,研究人员分别在FAP高表达的细胞来源移植小鼠模型(Cell-derived xenograft,CDX)和患者来源移植小鼠模型(Patient-derived xenograft,PDX)中进一步验证,发现Ga-68(t1/2=67 min)标记的CTR-FAPI(即[68Ga]Ga-FAPI-mFS)显示出比原始FAPI高2倍以上的肿瘤摄取,而健康组织中的摄取迅速清除(图2)。在一项初步的肿瘤成像临床研究中,这一策略比其他方法(包括传统FAPI-PET/CT)识别出了更多的甲状腺髓样癌病灶,并通过手术和病理研究确认了这些病灶为真阳性(图3)。以上结果说明CTR-FAPI有潜力成为下一代更高灵敏度的FAPI-PET探针。
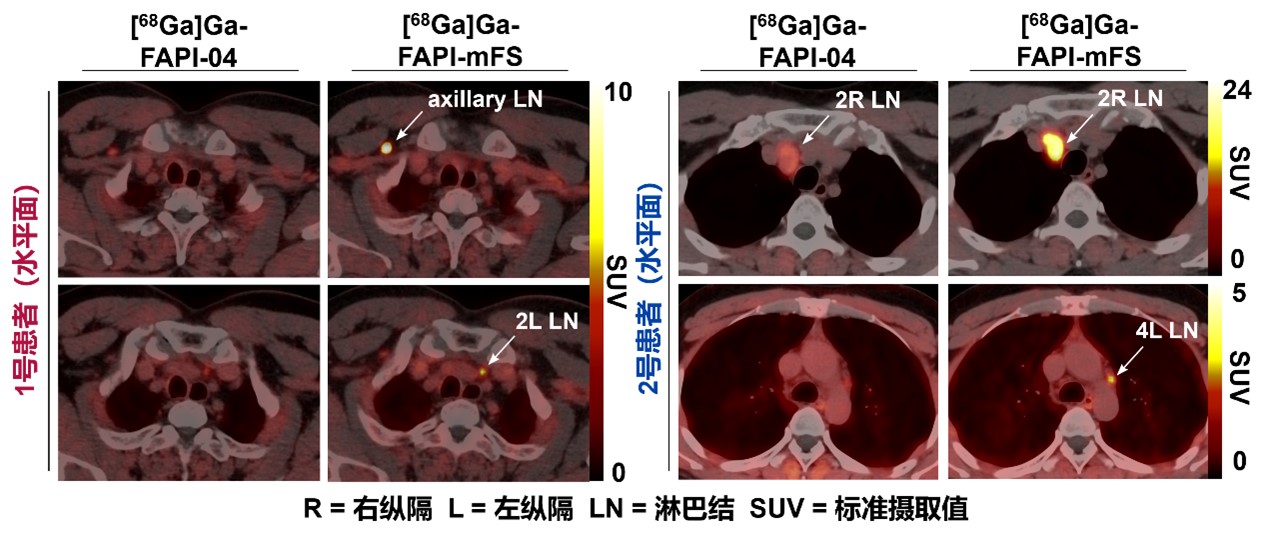
图3 靶向共价放射性药物在癌症病人中灵敏度高,可以发现现有药物难以诊断的肿瘤病灶
3. CTR通过提高滞留增强靶向放射性核素治疗
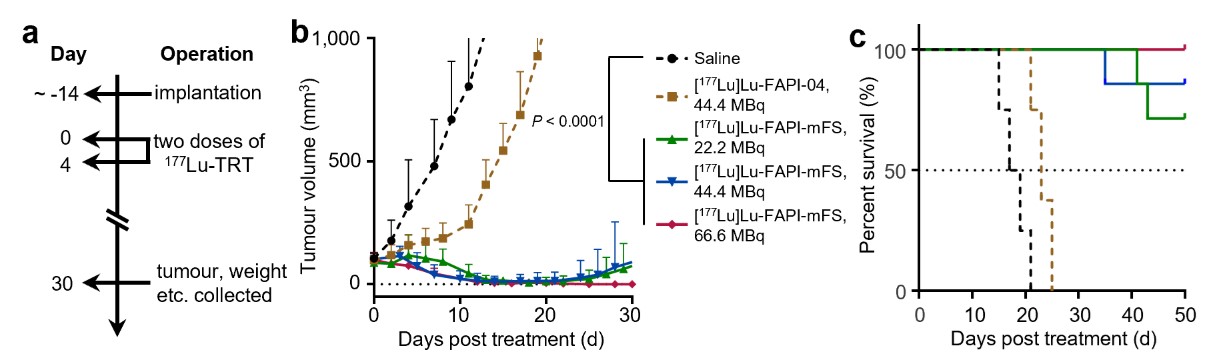
图4 [177Lu]CTR-FAPI可几乎完全抑制肿瘤生长,并延长小鼠生存期。a, 治疗方案;b, 肿瘤生长曲线;c, 生存曲线。
研究者进一步地采用长半衰期的Y-86(t1/2=14.7h)正电子核素考察了CTR-FAPI的长时间药代动力学,发现肿瘤处摄取的积分下面积(area under curve, AUC)增加约10倍。基于Lu-177(t1/2=6.7d)标记的CTR-FAPI剂量学估算同样说明肿瘤有效剂量提高了10倍左右。最终,研究者分别采用β-(Lu-177)和α-放射性核素(Ac-225, t1/2=9.9d)标记CTR-FAPI,在后续治疗中几乎完全抑制了小鼠的FAP高表达皮下肿瘤生长(图4)。在另一种靶向前列腺特异性膜抗原(PSMA)的SuFEx工程化放射配体也显示出更强的治疗效果。由于可连接SuFEx弹头的蛋白质较为广泛,这一策略或可用于靶向其他靶点的放射性药物,并为调控其他低分子量偶联类药物的药代动力学提供了新途径。
北京大学、北大-清华生命科学联合中心、昌平实验室的刘志博教授为该论文通讯作者。昌平实验室崔希洋副研究员(原北京大学化学与分子工程学院博雅博士后)、北京大学肿瘤医院李詝主治医师、国家癌症中心/医科院肿瘤医院孔梓任医师为论文共同第一作者。该研究成果得到国家自然科学基金委、科技部、北京分子科学国家研究中心、北大-清华生命科学联合中心、昌平实验室、北京大学肿瘤医院等机构和项目的资助。该研究还得到了国家癌症中心/医科院肿瘤医院头颈外科刘绍严主任,北京大学肿瘤医院核医学科杨志主任,北京协和医院核医学科霍力主任,北大王初教授课题组,北大分析测试中心周文和刘霞老师,以及北大天然药物与仿生药物国重室王倩老师等的大力支持和帮助。
论文链接:https://www.nature.com/articles/s41586-024-07461-6