
-

生物通官微
陪你抓住生命科技
跳动的脉搏
NatureChemicalBiology∣北京大学吕丹/游富平/尹玉新团队合作发现一种新...
【字体: 大 中 小 】 时间:2024年05月23日 来源:北京大学基础医学院
编辑推荐:
2024年5月22日,北京大学基础医学院吕丹研究员联合游富平研究员、尹玉新教授的研究团队在NatureChemicalBiology上发表了题为“RNA-binding protein PTENα blocks RIG-I activation to prevent viral inflammation”的最新研究成果
5'-三磷酸(5'-PPP)RNA被认为是一种病原体相关分子模式(PAMP),能够被模式识别受体RIG-I所识别,并引发宿主抗病毒的天然免疫反应。然而,鲜为人知的是,实际上,每秒钟哺乳动物细胞内会产生数百万个5'-PPP修饰的转录本。其中一些转录本,特别是由RNA聚合酶III介导的转录本,具有高度有序的结构并保持为5'-PPP,具有潜在激活RIG-I的能力。细胞是如何在保持足够的敏感性以快速检测到外源性RNA并触发有效的抗病毒反应的同时,又防止自体RNA异常诱导自身免疫反应的呢?这个问题一直困扰着研究者。
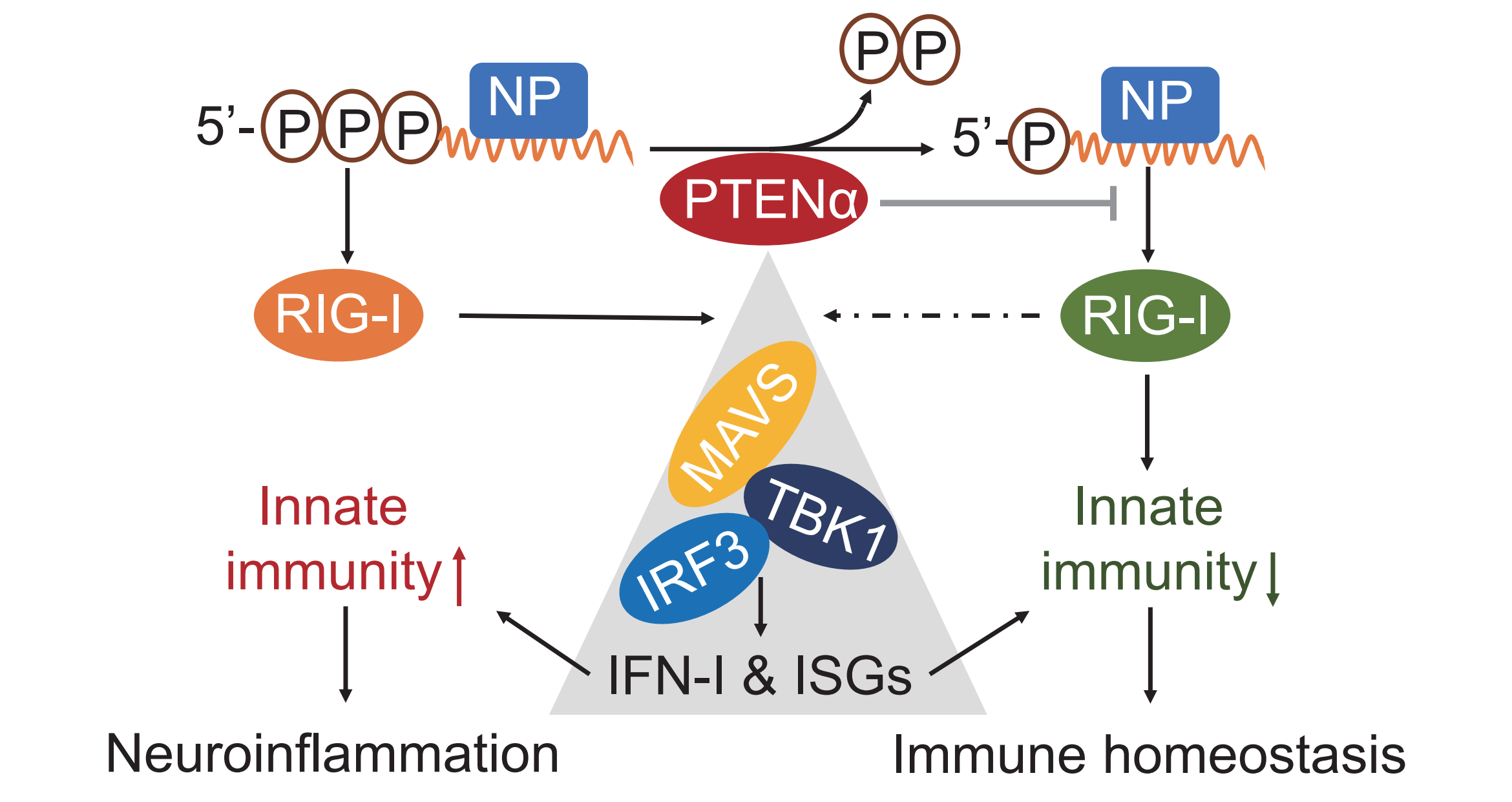
2024年5月22日,北京大学基础医学院吕丹研究员联合游富平研究员、尹玉新教授的研究团队在NatureChemicalBiology上发表了题为“RNA-binding protein PTENα blocks RIG-I activation to prevent viral inflammation”的最新研究成果。此研究发现,与经典的PTEN蛋白不同,PTEN家族新成员PTENα不仅影响脂质和蛋白磷酸化水平,还作为RNA磷酸酶,参与调控RIG-I的活化与功能。胞浆中定位的PTENα能够直接与病毒以及宿主RNA结合,并通过其磷酸酶活性将病毒RNA的5'端三磷酸化修饰转化为单磷酸化修饰,从而限制了宿主天然免疫应答的识别与活化。

北京大学基础医学院吕丹课题组长期致力于炎症与自身免疫性疾病发病机制的研究。此前实验室在RIG-I基因转录本中鉴定到了首个circRIG-I(Nat Commun. 2022),并在肠癌标本中鉴定到了RIG-I家族新亚型PTIR1分子(Cell Rep. 2023)。在本次研究中,研究者首先利用免疫沉淀联合质谱分析技术,分析宿主细胞中与病毒核衣壳(N)蛋白发生互作的蛋白种类,鉴定到了多条PTEN蛋白肽段。随后研究发现,只有PTEN家族新成员PTENα能够与病毒N蛋白结合,并且此结合是以一种RNA依赖性的方式实现的。
相较于PTEN,PTENα蛋白的N端含有一个富含碱性氨基酸的无序区,该区域赋予了其与核酸结合的能力。研究者通过相关实验发现,PTENα可以作为一种RNA结合蛋白,与含有CAUC(G/U)UCAU基序的RNA相结合。有趣的是,多种病毒均含有类似的模序。随后研究者通过体内和体外多种实验证明,内源性PTENα的缺失可以增强宿主的抗病毒免疫应答,从而限制病毒在体内的复制。然而,中枢神经系统中PTENα的缺失却会引发过强的炎症反应,加重病毒性脑炎的进程。
综上所述,此项研究揭示了磷酸酶PTENα在调控病毒RNA磷酸化修饰以及RIG-I介导的免疫应答过程中的重要作用。而靶向外周组织中PTENα信号通路,可以提高宿主抗病毒免疫应答。因此,此项研究为病毒感染的免疫治疗提供了潜在策略。
北京大学基础医学院硕士生殷悦、北京大学基础医学院八年制博士生杨泽亮以及哈佛大学孙祎喆博士为该论文的共同第一作者,北京大学基础医学院吕丹研究员、游富平研究员以及尹玉新教授为共同通讯作者。此项研究得到了国家自然科学基金优秀青年项目、国家自然科学基金面上项目以及北京市自然科学基金海淀联合基金项目的资助与支持。