
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命学院陈春来课题组与合作者揭示配体效能调控μ型阿片受体构象动态变化的分子机制
【字体: 大 中 小 】 时间:2024年04月17日 来源:清华园生命学院
编辑推荐:
在临床治疗领域,阿片类药物,如吗啡和芬太尼,是目前临床上最常用的强效镇痛药,它们通过激活脑内的μ型阿片受体(μOR)产生镇痛效果。阿片类药物的使用历史悠久,鸦片的使用可追溯到5000多年前的古代苏美尔文明,而使用提纯的吗啡已有200多年的历史。然而,阿片类药物的长期使用可能导致依赖性、耐受性增加以及严重的副作用,如便秘和致死的呼吸抑制。2000年以来,阿片类药物过量使用已经造成约40万人死亡。正在发生的阿片危机...
在临床治疗领域,阿片类药物,如吗啡和芬太尼,是目前临床上最常用的强效镇痛药,它们通过激活脑内的μ型阿片受体(μOR)产生镇痛效果。阿片类药物的使用历史悠久,鸦片的使用可追溯到5000多年前的古代苏美尔文明,而使用提纯的吗啡已有200多年的历史。然而,阿片类药物的长期使用可能导致依赖性、耐受性增加以及严重的副作用,如便秘和致死的呼吸抑制。2000年以来,阿片类药物过量使用已经造成约40万人死亡。正在发生的阿片危机在2018年造成了约7千亿美元的经济损失,约占美国GDP的3.4%。因此,解析μOR的激活机制及其与不同药物的相互作用对开发新型镇痛药物具有重要的理论和实际意义。
2024年4月10日,清华大学生命科学学院陈春来课题组与斯坦福大学 Brian Kobilka课题组、加州大学洛杉矶分校 Wayne Hubbell 课题组以及圣路易斯华盛顿大学车涛课题组合作,在《自然》(Nature)杂志发表了题目为“配体效能调控μ型阿片受体的构象动态(Ligand efficacy modulates conformational dynamics of the μ-opioid receptor)”的研究论文。通过采用先进的双电子-电子共振(DEER)和单分子荧光共振能量转移(smFRET)技术,科研团队揭示了μOR在不同配体和胞内下游信号蛋白作用下的重要亚稳态构象和构象之间的动态变化。研究发现,配体通过调节μOR在不同亚稳态构象之间的动态平衡,进而影响受体对细胞内信号分子的激活能力,即内在效能。
μOR属于G蛋白偶联受体(GPCR)家族,这是一类广泛存在于细胞表面,通过接收外部信号并启动细胞内响应的膜蛋白。GPCR家族的成员参与了多种生命过程,从视觉和嗅觉到神经传递和细胞内信号转导,因而成为了众多药物开发的靶点。从Kobilka 课题组2007年发表第一个非视紫红质的GPCR(β2AR)结构以及2011年发表第一个GPCR-G蛋白复合物结构至今,不断涌现的GPCR与配体以及胞内信号蛋白的高分辨率结构极大增强了我们对GPCR结构和功能的理解。作为一类复杂的、高度动态的别构调控膜蛋白,GPCR在配体作用下可在不同构象之间变化,进而激活下游的G蛋白或者招募β-arrestin(图一)。然而,X射线晶体学和冷冻电镜(Cryo-EM)等结构生物学方法只能捕获GPCR最稳定的构象。那些可能决定了GPCR功能的中间态构象或者低比例的构象却难以被捕捉。相比之下,DEER技术能在亚埃级分辨率下获得蛋白的不同构象及其比例,而smFRET技术能够实时地获得蛋白构象动态变化的信息。因此,这两项技术在空间解析和时间解析方面相互补充,有效地揭示了μOR与配体相互作用以及激活下游信号蛋白的分子机制。
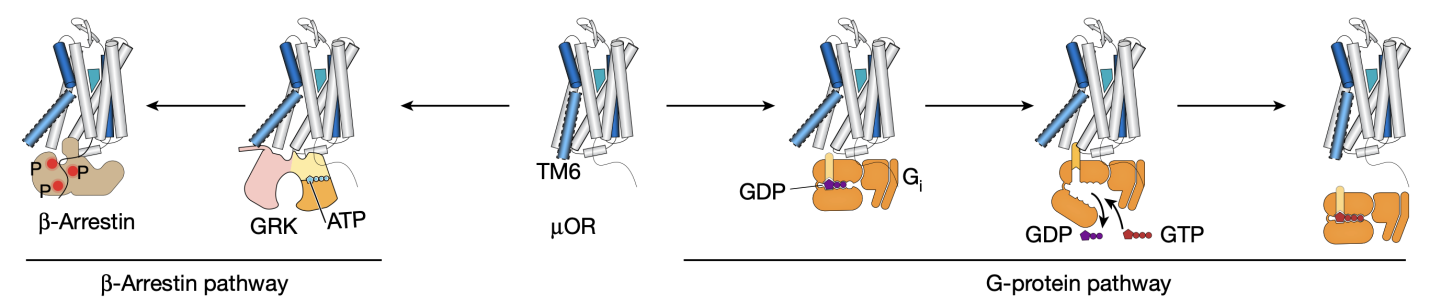
图 一 、μ型阿片受体(μOR)与下游信号。
本研究中,研究人员首先使用一种新型的硝基氧自由基标记物来标记 μOR 的第四和第六跨膜螺旋(TM4和TM6)的胞内端。通过DEER技术,研究人员获得了μOR 在吗啡等九种不同配体以及胞内信号蛋白G蛋白或者β-arrestin 存在时的构象分布(图二)。结果显示,μOR存在4种不同的构象,其中两种构象为抑制状态(命名为R1和R2),两种构象为激活状态(R3和R4)。然而,以往的晶体学和冷冻电镜研究只揭示了一种抑制状态和一种激活状态的构象。通过对比不同条件下μOR的构象分布,研究人员发现,与低效能(low efficacy)配体(如TRV130)相比,高效能(high efficacy)的配体(如lofentanil)在没有下游G蛋白结合时,就能够明显增加μOR在激活状态的比例。但是当有G蛋白存在时,不同效能的配体均能稳定μOR的R3和R4激活状态构象,以R3构象为主。这表明配体的效能与其单独存在时稳定激活状态构象的能力相关。与G蛋白相比,β-arrestin结合μOR的能力较差,且主要结合μOR的R4构象,这一方面说明μOR可能以不同的构象结合G蛋白和β-arrestin,另一方面展示了高效能的配体能更强地招募β-arrestin的原因是其能够增加R4状态的比例。

图 二 、双电子-电子共振(DEER)揭示的μOR的构象变化。
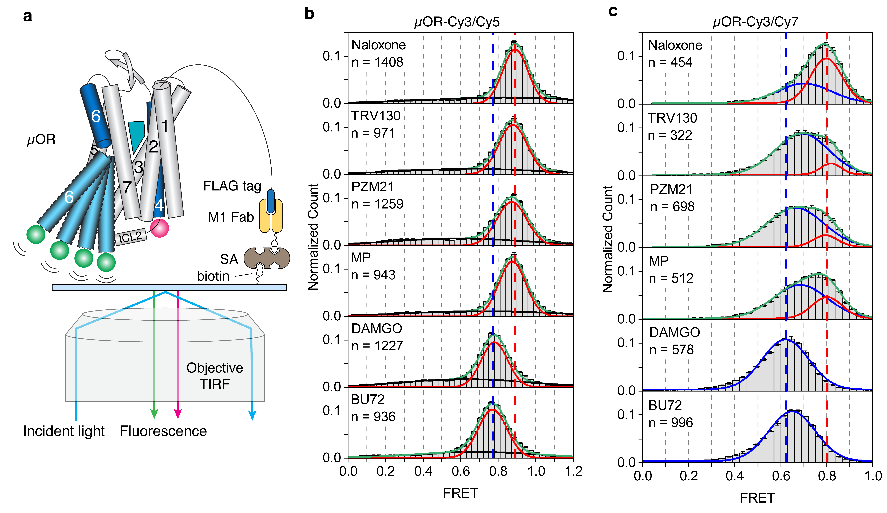
图 三 、smFRET实验揭示的μOR的构象分布。
那么不同效能的配体如何通过调控μOR的构象变化来影响下游G蛋白信号的呢?研究人员使用荧光分子标记μOR的TM4和TM6,并且使用smFRET技术观测μOR在不同配体和G蛋白、GDP存在时的构象分布及变化速率(图三和图四)。与DEER的结果相一致,smFRET实验结果显示,μOR在低效能配体存在时更倾向于抑制状态,而在高效能配体存在时更倾向于激活状态。当研究者标记μOR的第二个胞内环圈(ICL2)而不是TM4时,smFRET观测到了拮抗剂或者低效能配体结合的μOR存在两个状态,其构象变化可能与配体的低效能相关。研究人员进一步实时观测了在有G蛋白和不同浓度GDP存在时μOR在激活状态和抑制状态之间的变化(图四)。数据分析显示,结合G蛋白时,μOR存在两个激活状态,分别对应了两种G蛋白的状态:结合GDP的G蛋白(EFRET=0.6)和不结合GDP的G蛋白(EFRET=0.5)。与低效能的配体相比,高效能配体增加了结合不含GDP的G蛋白的μOR比例,即更容易使G蛋白的GDP释放从而结合GTP,进而激活G蛋白。此外,高效能配体能促使μOR快速地结合G蛋白,并且增加G蛋白结合的稳定性从而增加GTP结合的概率。
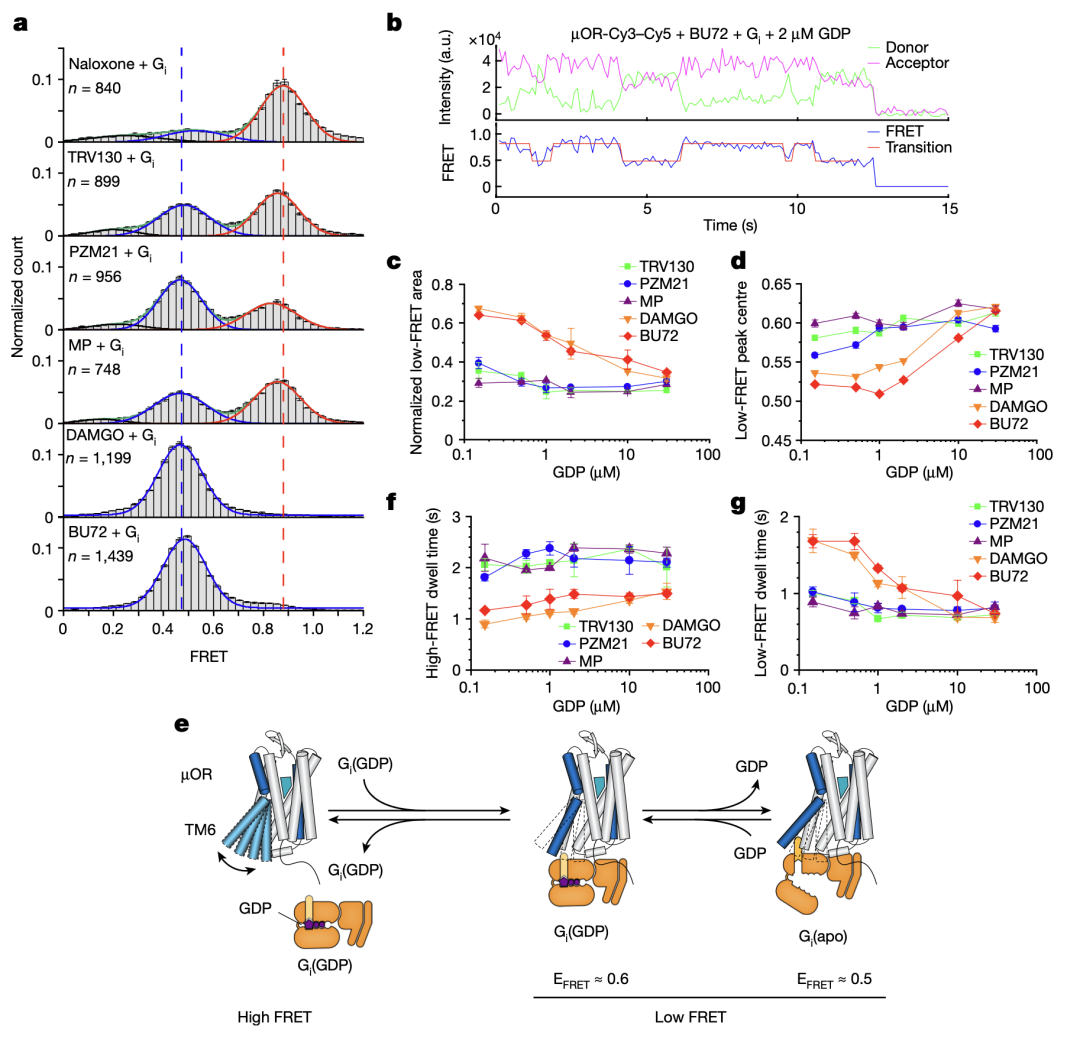
图 四 、smFRET揭示的μOR的构象动态变化。
总的来说,这项研究不仅提高了我们对μOR激活机制的理解,也为开发新型的、副作用更小的镇痛药物提供了理论基础。随着对GPCR动态结构和功能之间关系的进一步探索,未来有望开发出更为安全有效的治疗方案,以更好地应对疼痛和其他相关疾病。
清华大学生命科学学院陈春来副教授、斯坦福大学Brian Kobilka教授和加州大学洛杉矶分校博士后 Matthias Elgeti(现为莱比锡大学医学院研究员)为本文共同通讯作者;清华大学生命学院清华-北大生命科学联合中心2013级博士生、原医学院博士后赵佳伟(现为哈佛大学医学院 del Mármol 课题组博士后)与 Matthias Elgeti 为共同第一作者。清华大学原医学院博士后衡杰博士和基础医学院孙晓鸥博士参与了本项目研究。本工作获得了国家自然科学基金委、北京生物结构前沿研究中心、北京结构生物学高精尖创新中心、膜生物学国家重点实验室、以及清华-北大生命科学联合中心的经费支持。