
-

生物通官微
陪你抓住生命科技
跳动的脉搏
JACS | 上海药物所开发蛋白质N-端组学深度检测方法
【字体: 大 中 小 】 时间:2024年03月28日 来源:中国科学院上海药物研究所
编辑推荐:
2024年2月29日,中国科学院上海药物研究所黄河团队和柳红团队合作,在国际学术期刊J Am Chem Soc上发表了题为“Advancing In-Depth N-Terminomics Detection with a Cleavable 2-Pyridinecarboxyaldehyde Probe”的研究论文
2024年2月29日,中国科学院上海药物研究所黄河团队和柳红团队合作,在国际学术期刊J Am Chem Soc上发表了题为“Advancing In-Depth N-Terminomics Detection with a Cleavable 2-Pyridinecarboxyaldehyde Probe”的研究论文。该研究设计合成了一种含有吡啶甲醛片段的可断裂分子探针2PCA-Probe,可实现对蛋白质N-端的深度富集检测。
蛋白质水解是一种广泛存在的翻译后修饰方式,在多种生物过程中发挥重要作用。在正常组织中,大多数蛋白酶的活性受到严格调控,而在肿瘤组织中蛋白酶则往往被异常激活,并通过介导免疫逃逸、肿瘤细胞侵袭等多个途径促进肿瘤的发生发展。蛋白质在水解后会产生新的N-端,因此通过对蛋白质N-端进行系统检测即可获得蛋白水解断裂信息。然而,现有的N-端组学检测方法存在操作复杂、检测深度不高等缺陷,限制了蛋白水解相关研究的进展。
在本项研究中,科研人员发现吡啶甲醛片段与N-端氨基酸不仅可以选择性发生环化反应形成咪唑烷酮结构,还可发生羟醛缩合反应,由此发现该类标记方法生成的新诊断片段。通过该诊断片段信息,可以规避以前此类探针标记时遇到的限制,即无法标记2位氨基酸为脯氨酸的多肽。
利用该方法,研究团队对三对结直肠癌组织和癌旁组织的N-端组进行了深度富集检测,共鉴定到了4686种N端多肽。进一步分析显示,肿瘤组织中的蛋白水解过程相较于癌旁组织更为活跃,并且肿瘤组织中发生水解的蛋白主要富集在代谢通路和免疫通路,这可能与肿瘤组织的代谢重编程和免疫逃逸过程相关。该研究建立了一种全新的N-端组深度检测方法,为疾病发病机制中的蛋白质水解过程研究提供了有力的新工具。
上海药物所黄河课题组博士后宋晓翰(原柳红课题组博士研究生)和研究助理任雪莲为该论文的共同第一作者,上海药物所黄河研究员和柳红研究员为本文的共同通讯作者。该工作还得到了华中科技大学同济医学院梅齐副主任医师的大力支持。本研究得到国家自然科学基金委、上海市自然科学基金和上海市市级科技重大专项的基金资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.4c02222
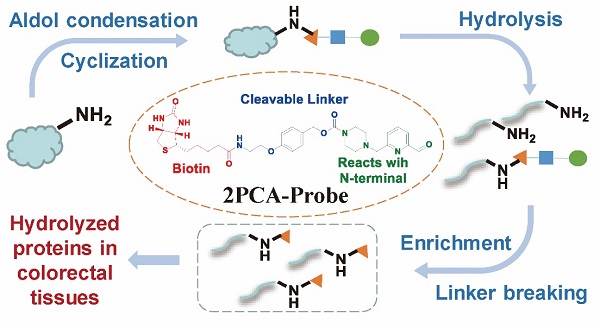
2PCA-Probe探针结构及标记检测流程
(供稿部门:黄河课题组;供稿人:宋晓翰)