
-

生物通官微
陪你抓住生命科技
跳动的脉搏
中国科大在肠道微生态环境与肿瘤免疫微环境互作机制探究中取得重...
【字体: 大 中 小 】 时间:2024年03月26日 来源:中国科学技术大学生命科学与医学部基础医学院
编辑推荐:
2024年3月12日,中国科学技术大学生命科学与医学部基础医学院、免疫应答与免疫治疗重点实验室朱书教授和潘文教授课题组合作在Immunity上发表了文章Bile acids modified by the intestinal microbiota promote colorectal cancer growth by suppressing CD8 + T cell effector functions,该项研究成果发现结直肠癌中微生物C. scindens介导的肿瘤免疫逃逸机制,并开发了基于噬菌体的干预方法,对特定结直肠癌患病风险人群的预防、特定结直肠癌患者的免疫治疗及术后复发的控制皆有潜在意义
2024年3月12日,中国科学技术大学生命科学与医学部基础医学院、免疫应答与免疫治疗重点实验室朱书教授和潘文教授课题组合作在Immunity上发表了文章Bile acids modified by the intestinal microbiota promote colorectal cancer growth by suppressing CD8+ T cell effector functions,该项研究成果发现结直肠癌中微生物C. scindens介导的肿瘤免疫逃逸机制,并开发了基于噬菌体的干预方法,对特定结直肠癌患病风险人群的预防、特定结直肠癌患者的免疫治疗及术后复发的控制皆有潜在意义。
结直肠癌是消化系统恶性肿瘤之一,其新发病例数在全世界男性、女性中分别排名第3位及第2位,死亡病例数在全世界男性、女性中分别排名第4位及第3位。结直肠癌在我国发病率逐年上升,在全部恶性肿瘤中发病数居第2位、死亡数居第4位。
结直肠癌的高发病率以及针对免疫治疗的低响应率,亟需寻找其环境阻滞因素以寻找更精准有效的治疗手段。众所周知结肠部位最明显的特征便是分布有巨量的肠道微生物,过去几十年,研究人员发现伤寒杆菌(S. typhi)和聚合梭杆菌(F. nucleatum)均可通过活化Wnt/β-catenin通路成为结直肠癌的风险因素[1],但这仅仅是肠道存在的1013次方细菌对宿主影响的冰山一角。在今年1月发表的一篇Nature Cell Biology论文中,朱书课题组与山东大学初波课题组合作,发现结直肠癌患者肠道中厌氧消化链球菌(P. anaerobius)富集,P. anaerobius分泌色氨酸代谢物IDA,是AHR的天然配体,通过激活肠道上皮细胞ALDH1A3-FSP1-CoQ10轴抵抗铁死亡,对肿瘤预后有不良影响。实际上,肠道不仅分布有大量上皮细胞,人体一半以上的免疫细胞、70%以上的T细胞都分布在肠道这个最大的黏膜免疫器官中。
CD8+ T细胞是抵抗肿瘤的核心免疫细胞。在肿瘤发生早期,初始CD8+ T细胞接受抗原和共刺激信号,启动TCR信号转导,使得胞内Ca2+的浓度增加,转录因子NFAT入核启动IFN-γ和TNF等效应分子转录表达,激活CD8+ T细胞。活化的CD8+ T细胞通过分泌细胞因子和释放Granzyme B等途径协助机体清除肿瘤细胞。结直肠癌发生后,肿瘤微环境中浸润的CD8+T细胞功能异常,其浸润数量和基因表达模式是结直肠癌的重要预后指标,其中高比例CD8+T细胞浸润、高表达Granzyme B表征良好预后。然而,在结直肠癌肿瘤微环境中,CD8+T细胞功能异常是否与改变的肠道细菌/代谢物有关,以及何种细菌/代谢物影响CD8+T细胞抗肿瘤功能目前仍知之甚少。
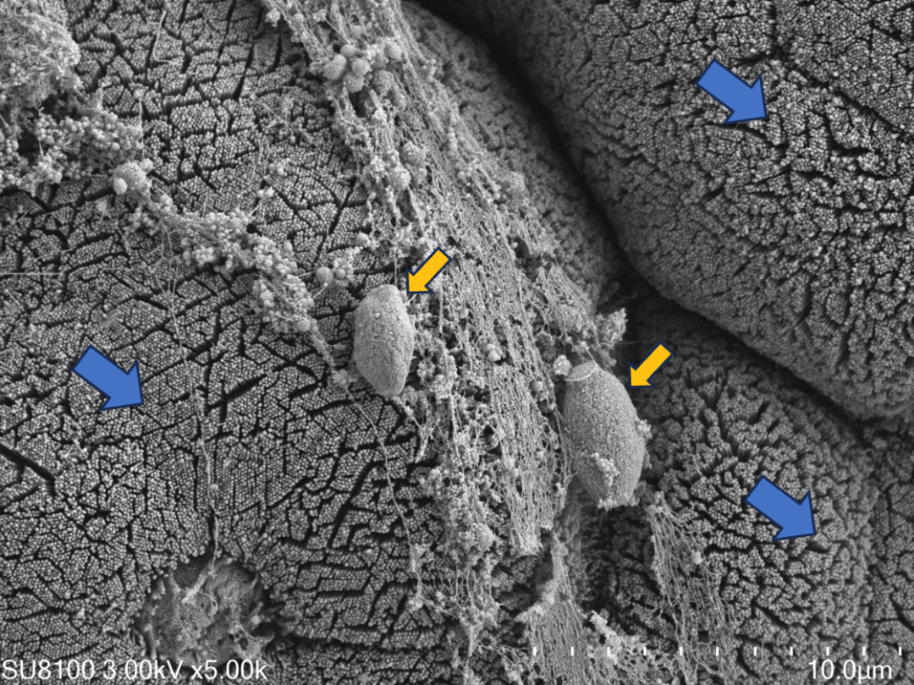
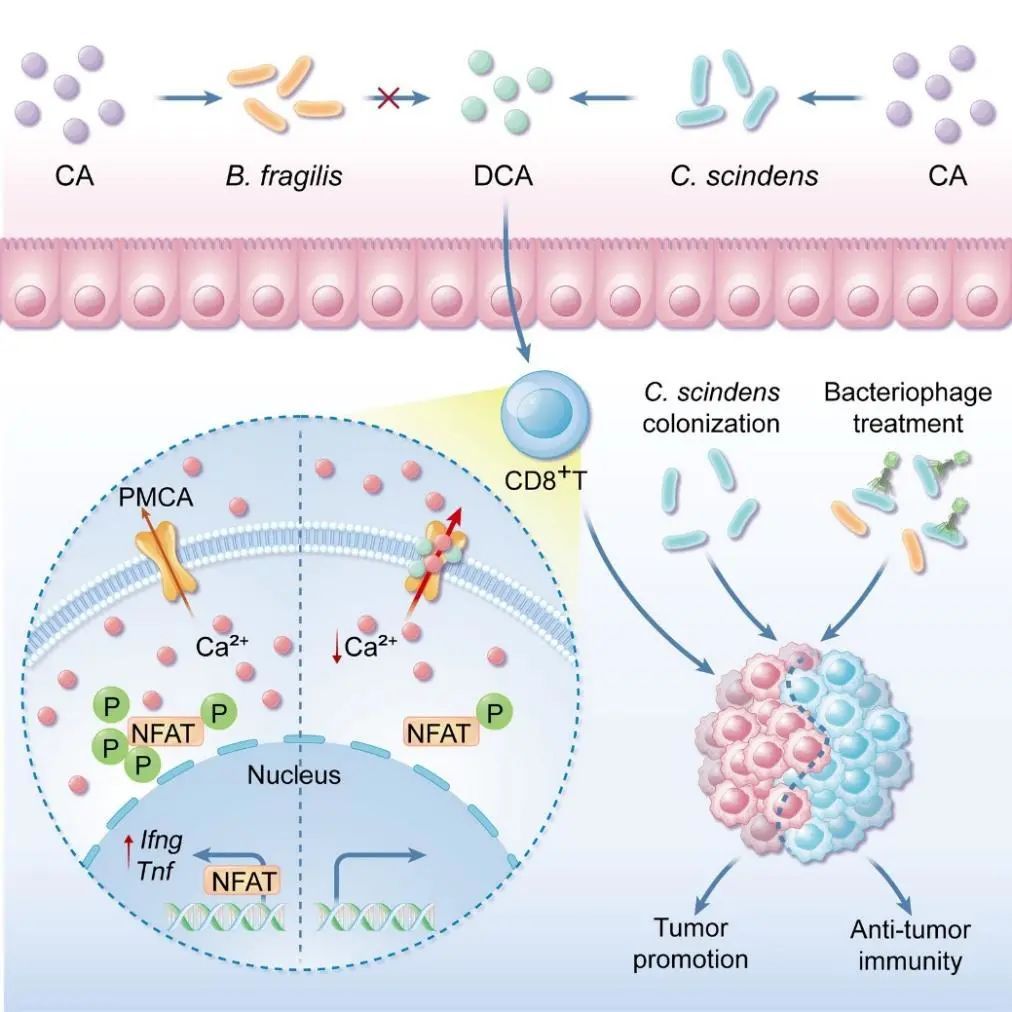
蓝色箭头:IECs;黄色箭头:产DCA的梭菌属
为寻找调控CD8+ T细胞抗肿瘤功能细菌/代谢物,研究团队构建了肠道微生物来源的小分子代谢物库,通过体外筛选和体内验证,发现C. scindens通过bai operon产生的次级胆汁酸脱氧胆酸(DCA)可以有效抑制CD8+ T细胞的效应功能,并促进结直肠癌生长。进一步研究发现,DCA可能是与细胞膜钙泵PMCA结合,增强其活性,从而促进其介导的Ca2+外排,导致了胞浆内Ca2+浓度降低,抑制NFAT2激活,进而削弱CD8+ T细胞的效应功能。阻断细菌DCA生物合成通路,可有效抑制细菌对CD8+ T细胞效应功能的抑制,从而阻断DCA对小鼠肿瘤生长的影响。特异性靶向裂解C. scindens的噬菌体,可有效抑制C. scindens的免疫抑制以及促肿瘤效应。这项研究揭示了肠道微生态环境与肿瘤免疫微环境互作的新通路,为解除特定微生物带来的对于免疫细胞的抑制进而对特定结直肠癌患病风险人群的预防、特定结直肠癌患者的免疫治疗及术后复发的控制皆有潜在意义。
中国科大朱书和潘文教授为文章的共同通讯作者,朱书组博后丛靖婧(现为安徽医科大学教授),潘文组博士生刘偏偏,朱书组博士生韩自莉,为本工作的共同第一作者。这个工作也获得多位合作者的大力帮助:中科大孙林峰教授以及仓春蕾教授提供了DCA调控钙泵活性、钙离子成像的支持;深圳先进院戴磊教授、康奈尔大学郭春君教授、上海生化所宋昕阳研究员在微生物编辑及噬菌体筛选上提供了支持;哈佛大学Dennis Kasper教授和上海生化所宋昕阳研究员在排除DCA通过传统受体影响CTL上提供了支持;上海长海医院消化科柏愚主任、王树玲医生提供了CRC病人关联性分析的支持。此外,中科大周荣斌教授、周丛照教授、以及陆军军医大学叶丽林教授也提供了大量实验支持和指导意见。
论文链接:https://doi.org/10.1016/j.immuni.2024.02.014
(生命科学与医学部、科研部)