
-

生物通官微
陪你抓住生命科技
跳动的脉搏
王坚成团队在纳米药物促进干细胞软骨再生治疗骨关节炎研究领域取得新进展
【字体: 大 中 小 】 时间:2024年03月16日 来源:北京大学药学院
编辑推荐:
202 4 年 3 月 7 日,我院天然药物及仿生药物 全 国重点实验室王坚成 教授 / 朱元军博士 团队 和北京大学第三医院运动医学江东主任医师团队 共同 在国际学术期刊 A CS N ano 在线 发表了题为 “ Nanomedicines Promote Cartilage Regeneration in Osteoarthritis by Synergistically Enhancing Chondrogenesis of Mesenchymal Stem Cells and Regulating Inflammatory Environment ” 的研究 论文
2024年3月7日,我院天然药物及仿生药物全国重点实验室王坚成教授/朱元军博士团队和北京大学第三医院运动医学江东主任医师团队共同在国际学术期刊ACS Nano在线发表了题为“Nanomedicines Promote Cartilage Regeneration in Osteoarthritis by Synergistically Enhancing Chondrogenesis of Mesenchymal Stem Cells and Regulating Inflammatory Environment”的研究论文。该研究提出了碳酸酐酶IX siRNA(siCA9)调控炎症微环境调控促进Kartogenin(KGN)诱导的间充质干细胞(MSCs)软骨定向分化作用的新策略,显著提高了MSCs在骨关节炎(OA)治疗中的软骨再生能力,改善了晚期OA治疗效应。

OA是一种普遍的退行性关节疾病,其主要病理特征是关节软骨损伤和滑膜炎症,随着老龄化趋势增长,其发病率和致残率逐年上升,不仅严重影响患者生活质量,还加重了社会卫生保健系统的负担。然而目前治疗OA的临床药物仅能缓解疼痛,改善症状,但无法有效阻止OA进展。因此,开发新的治疗策略对于改善OA治疗效应具有重要科学意义和临床价值。
该团队前期研究(Adv. Sci. 2023, 2207490)中通过首次负载递送碳酸酐酶IX siRNA(siCA9)的纳米粒高效沉默CA9基因表达,缓解了OA酸性滑液微环境(pH 6.6-7.2),有利于巨噬细胞从M1表型转化为M2表型的重编程,成功逆转了炎症微环境,有效抑制了OA进展。然而,即使炎症得到了控制,OA中软骨损伤仍然难以修复和再生。
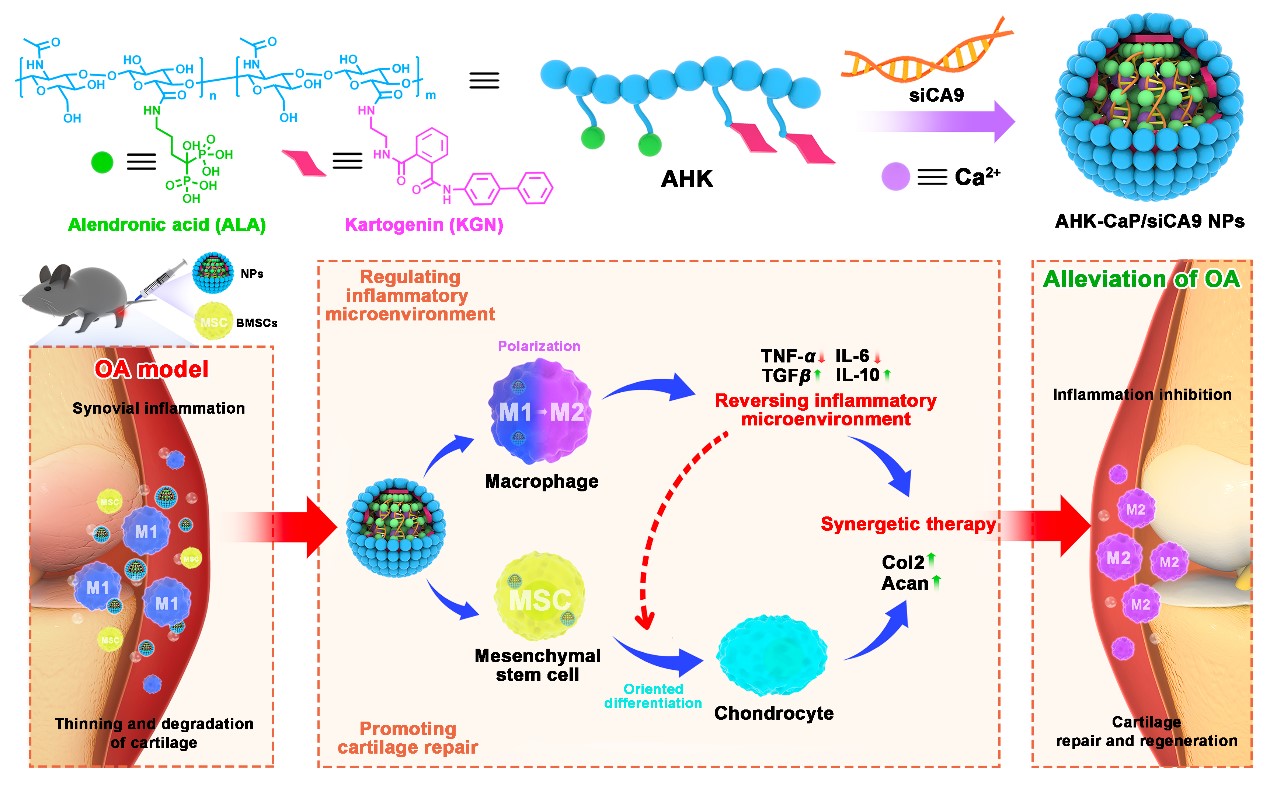
近些年来,间充质干细胞(MSCs)移植用于临床OA软骨修复正在兴起。MSCs具有多能分化潜能、低免疫原性和分泌生物活性因子的优势。在临床试验中,关节内(IA)注射不同来源的MSCs可以有利于软骨损伤修复并缓解膝关节炎的疼痛,并改善其功能。尽管如此,MSCs疗法的临床转化仍面临挑战。OA组织中存在的炎症微环境严重影响了MSCs定向分化为软骨细胞的效率。另外,疏水性小分子化合物Kartogenin(KGN)已被证明可有效促进MSCs定向分化为软骨细胞,但KGN小分子单独应用面临体内快速清除。
本研究开发了一种共载siCA9和KGN的新型纳米药物,并将其与外源性MSCs联合策略用于OA治疗。如图所示,阿仑膦酸和KGN接枝的透明质酸聚合物(AHK)中磷酸基团与钙离子螯合和siCA9结合形成核壳纳米颗粒(AHK-CaP/siCA9 NPs)。透明质酸(HA)是一种众所周知的天然关节润滑剂,表现出良好的生物相容性。阿仑膦酸盐作为双膦酸盐的家族成员,其结构中的磷酸基团与钙离子之间的配位结合作用,有利于在CaP/siRNA核上引入AHK外壳涂层。该纳米药物关节腔注射后,被巨噬细胞和MSCs摄取,从巨噬细胞中释放的siCA9介导CA9基因沉默,缓解了酸性微环境,通过重塑巨噬细胞表型,成功逆转炎症微环境。同时,纳米粒中释放的KGN有利于MSCs定向分化为软骨细胞,有效促进软骨再生修复。在单碘乙酸(MIA)诱导的晚期OA小鼠模型中,与单独使用MSCs组相比,外源性MSCs和AHK-CaP/siCA9 NPs联合治疗策略可有效抑制滑膜炎,并促进OA进展中的软骨再生修复。

左起:崔仕贺、闫仪、卢安
北京大学药学院2016级直博生崔仕贺、2022级博士后闫仪和2020级博士研究生卢安为该论文的共同第一作者;北京大学药学院王坚成教授、朱元军博士和北京大学第三医院运动医学科江东主任医师为该文的共同通讯作者。
这项工作得到了国家自然科学基金项目(No. 81973259,82072428和82173726)、北京市自然科学基金(No. 7214281和J200018)、宁波科技计划项目(No. 2022Z142)、北京大学优秀人才项目(BMU2022XY024)支持。
论文链接:https://doi.org/10.1021/acsnano.3c11848
通讯作者简介

王坚成,北京大学博雅特聘教授,教育部长江学者特聘教授,药学院药剂学系博士生导师,天然药物及仿生药物全国重点实验室课题组组长,科技部中青年科技创新领军人才、教育部新世纪优秀人才。现任北京大学医学部科研处处长,北京大学宁波海洋药物研究院副院长,中国药学会药剂专业委员会委员,北京药学会药剂专业委员会主任委员。长期关注生物大分子给药系统研究,尤其是核酸药物递送系统的创新研究。已在Nat communication、Adv Science、Biomaterials、J Control Release等国际权威学术杂志发表SCI论文100余篇,获新药证书1项,临床批件2件,主译书籍《纳米粒药物输送系统》。主持承担siRNA递送相关研究的国家自然科学基金5项,主持国家重点研发计划项目、重大新药创制研发技术平台等国家级和省部级项目6项。

江东,北京大学第三医院运动医学科副主任,主任医师,博士生导师,教授。入选 “万人计划”青年拔尖人才。美国杜克大学足踝外科访问学者,现任中华医学会科普分会软骨修复学组常委、中国老年学和老年医学学会老年运动医学分会总干事、中国康复医学会足踝康复专委会常委、中国医师协会运动医学医师分会足踝学组青委会副主委、北京市医学会骨科分会青委会足踝外科委员会副主委、国家体育总局会诊专家等。研究方向为膝关节和足踝运动损伤的诊疗康复,干细胞、生物材料和关节组织再生。主持国家及省部级课题13项,以一作/通讯作者发表SCI收录论著40余篇,授权专利20余项。

朱元军,博士,北京大学药学院分子与细胞药理学系教师。主要研究方向为蛋白质/多肽药物的设计、基于内源性蛋白质的药物递送。已在Molecular therapy、J Control Release等国际知名期刊发表多篇SCI论文,获授权发明专利3项,担任人民卫生出版社《生物技术药物学》第9版教材编委。
天然药物及仿生药物全国重点实验室 供稿