
-

生物通官微
陪你抓住生命科技
跳动的脉搏
刘莉教授与合作团队在《Nature》发表论文揭示植物抗病蛋白激活新机制
【字体: 大 中 小 】 时间:2024年03月15日 来源:北京师范大学生命科学学院
编辑推荐:
2024年 3 月 13 日,北京师范大学生命科学学院刘莉教授与西湖大学柴继杰教授团队与德国马克斯普朗克研究所 Paul Schulze-Lefer t 教授团队、中国农业大学宋文教授合作,在 Nature杂志发表了题为 “Substrate-induced condensation activates plant TIR domain proteins” 的研究论文
2024年3月13日,北京师范大学生命科学学院刘莉教授与西湖大学柴继杰教授团队与德国马克斯普朗克研究所Paul Schulze-Lefert教授团队、中国农业大学宋文教授合作,在Nature杂志发表了题为“Substrate-induced condensation activates plant TIR domain proteins”的研究论文。该研究揭示了一类植物抗病蛋白通过底物诱导的凝聚体激活的新机制,不仅在植物免疫学研究领域具有重要的理论价值,而且对于培育新型抗病农作物品种具有潜在的指导意义。

植物免疫系统是植物抵抗病原物入侵的重要防线。由NLR抗病蛋白介导的植物病原物效应因子诱导免疫(ETI)是植物免疫系统的重要组成部分,通过细胞内的NLR蛋白特异识别病原物效应因子,激活植物强烈的免疫反应,引起侵染部位细胞程序性死亡,从而有效控制病原物的进一步侵染。NLR蛋白由N端结构域、中间的核苷酸结合寡聚结构域(NOD)和C端富亮氨酸重复序列结构域(LRR)组成。LRR和NOD分别负责信号识别和蛋白寡聚。根据N端结构域的不同,NLR可分为含有Toll/Interlukin-1/Resistance-gene(TIR)结构域的TIR-NLR和含有Coiled-coil结构域的CC-NLR。植物基因组除了编码典型的全长TIR-NLR蛋白,还会编码一些非典型的、截短的TIR结构域蛋白。特别是在水稻、小麦、玉米等单子叶植物中,只编码截短的TIR结构域蛋白,而没有TIR-NLR蛋白。TIR结构域蛋白不仅在ETI免疫反应中发挥作用,而且还可能参与调控病原物相关分子模式触发免疫(PTI)。近年来,TIR-NLR和CC-NLR被效应因子激活形成抗病小体介导ETI免疫反应的分子机制都得到了全面的解析。然而,缺少LRR和NOD结构域的TIR结构域蛋白激活的分子机制仍不清楚。
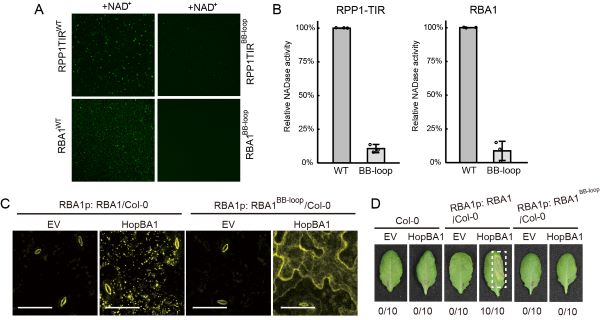
图1. TIR结构域蛋白体外、体内形成凝聚体,水解NAD+激活免疫反应。
刘莉教授和合作团队在实验中意外地发现体外纯化的TIR结构域蛋白能够在底物NAD+/ATP的作用下形成液体或凝胶状的蛋白凝聚体,并激活NAD+水解活性。在烟草叶片中过表达TIR结构域蛋白或病原菌诱导拟南芥中TIR结构域蛋白表达,会在细胞内源NAD+/ATP的诱导下形成蛋白凝聚,激活免疫反应和细胞死亡。通过突变TIR互作界面关键氨基酸位点打破凝聚体的形成会导致免疫和细胞死亡的丧失,而当重新建立TIR蛋白凝聚能力后,又会恢复免疫和细胞死亡表型。通过对比TIR结构域蛋白-NAD+复合物结构和TIR-NLR四聚化抗病小体结构,发现TIR结构域蛋白形成了与TIR-NLR类似的NAD+水解全酶结构。有意思的是,虽然TIR结构域蛋白没有NOD结构域帮助其稳定TIR四聚化,但是NAD+诱导了TIR结构域蛋白上被称为BB-loop的一段无序区发生了构象改变,从关闭构象转变为开放构象,介导了TIR-TIR头尾相连的互作,使蛋白寡聚化形成凝聚体,进而稳定了TIR之间的互作,组装全酶催化中心,产生激活植物免疫反应的信号分子。
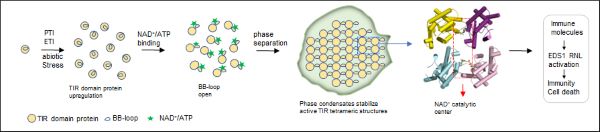
图2. NAD+/ATP诱导TIR结构域蛋白形成凝聚体激活NAD+水解酶活性的分子机制。
综上所述,该研究揭示了植物非典型TIR结构域蛋白通过底物NAD+/ATP诱导形成凝聚体激活的新机制。这种不依赖于病原菌效应因子的自主激活模式,赋予了TIR结构域抗病蛋白能够广泛参与调控ETI、PTI免疫反应以及非生物胁迫响应的能力。该研究还为重要粮食作物水稻、小麦、玉米中利用这一机制培育广谱抗病作物提供了重要线索。
中国农业大学生物学院宋文教授、北京师范大学生命科学学院刘莉教授为该文共同第一作者。西湖大学生命科学学院柴继杰教授,德国马克斯普朗克植物育种研究所Paul Schulze-Lefert教授为该文共同通讯作者。哈佛大学于东立博士,科隆大学Jan Jirschitzka 博士,西湖大学黄诗嘉博士,西湖实验室韩志富博士,马克斯普朗克植物育种研究所Jane Parker教授、Henriette Laessle博士,清华大学李丕龙教授、陈伟杰博士等也为该研究做出了重要贡献。