
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Cell Metabolism |刘强团队揭示了tRNA片段调控脑衰老和阿尔茨海默病的关键机制
【字体: 大 中 小 】 时间:2024年03月09日 来源:中国科学技术大学 | 生命科学与医学部
编辑推荐:
2024 年 3 月 8 日,中国科学技术大学刘强团队在《 Cell Metabolism 》杂志上在线发表了题为“ Aging-induced tRNA Glu -derived fragment impairs glutamate biosynthesis by targeting mitochondrial translation-dependent cristae organization ”的文章,揭示了在衰老和阿尔茨海默病的大脑中会产生大量的谷氨酸 tRNA 片段,并在线粒体内发生异常累积,导致线粒体蛋白的翻译发生损伤以及内嵴结构发生破坏,最终损伤谷氨酸的合成过程,加速大脑衰老和阿尔茨海默病的病理进程
大脑衰老的主要特征是认知功能的下降,包括情景记忆、工作记忆、信息处理速度等【1】。在大脑衰老进程中,被称为大脑细胞的“能量工厂”线粒体的结构发生明显的退行性改变,功能发生明显的下降【2-3】。然而,衰老过程中线粒体结构和功能改变的调控机制仍不清楚。衰老是阿尔茨海默病最重要的风险因素,认知功能障碍和线粒体结构功能异常也是阿尔茨海默病的重要病理特征【4-6】,但是衰老如何导致阿尔茨海默病的发生发展并不清楚。
2024年3月8日,中国科学技术大学刘强团队在《Cell Metabolism》杂志上在线发表了题为“Aging-induced tRNAGlu-derived fragment impairs glutamate biosynthesis by targeting mitochondrial translation-dependent cristae organization”的文章,揭示了在衰老和阿尔茨海默病的大脑中会产生大量的谷氨酸tRNA片段,并在线粒体内发生异常累积,导致线粒体蛋白的翻译发生损伤以及内嵴结构发生破坏,最终损伤谷氨酸的合成过程,加速大脑衰老和阿尔茨海默病的病理进程。

在这篇论文中,研究人员首先发现谷氨酸tRNA片段在大脑衰老进程中,其表达水平显著上升,并且这种增加具有物种保守性。除了衰老的大脑,在阿尔茨海默症病人的大脑中也同样检测到谷氨酸tRNA片段的增加。进一步的研究表明,谷氨酸tRNA片段的产生是依赖于angiogenin(ANG):ANG在衰老过程中从细胞核异常定位到细胞质,并对谷氨酸tRNA进行切割。
研究人员利用分子杂交以及免疫荧光等技术发现谷氨酸tRNA片段主要在谷氨酸能神经元中的线粒体内发生异常积累。通过RNA-pull down和蛋白质谱的方法鉴定了谷氨酸tRNA片段的结合蛋白-线粒体亮氨酸氨酰化合成酶(LaRs2)。研究人员利用生化实验和透射电镜技术发现谷氨酸tRNA片段和线粒体亮氨酸tRNA竞争性结合LaRs2,破坏线粒体亮氨酸tRNA的氨酰化以及线粒体蛋白的翻译过程,进一步损伤线粒体内嵴结构以及谷氨酰胺酶依赖的谷氨酸的合成过程,进而加速大脑衰老的进程。
设计靶向该tRNA片段的反义寡核苷酸,并注射到衰老小鼠的大脑内,可以通过恢复谷氨酸能神经元中线粒体的蛋白翻译,内嵴结构,以及脑谷氨酸水平,显著减轻衰老小鼠学习记忆障碍。这些研究结果进一步支持谷氨酸tRNA片段是加速大脑衰老的重要风险因子,这也为减缓脑衰老相关的学习记忆功能障碍提供了新的治疗靶点。
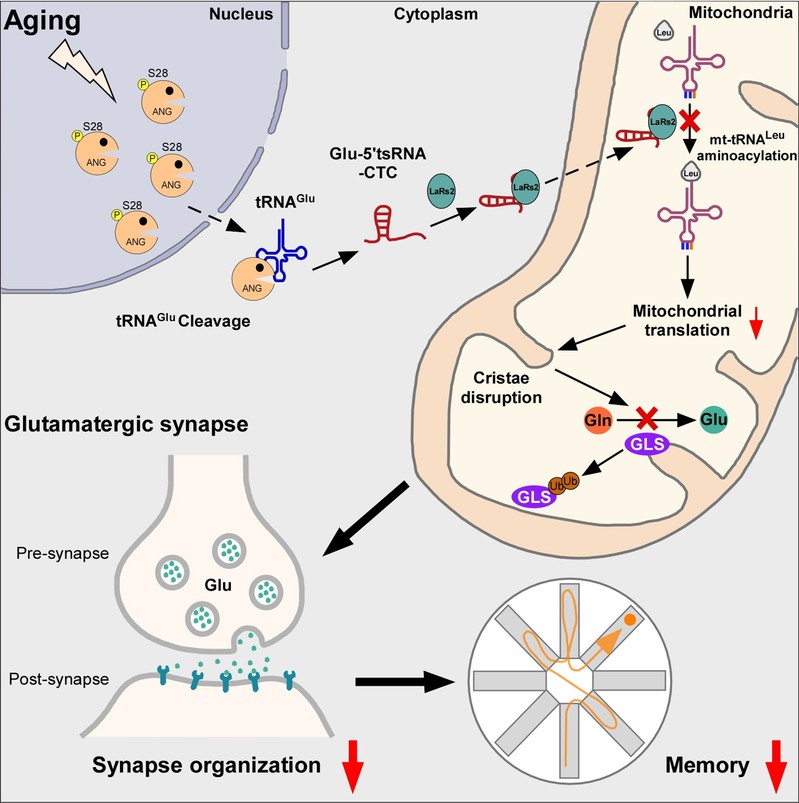
综上,这项研究揭示了在脑衰老和阿尔茨海默病中异常积累的谷氨酸tRNA片段通过损伤线粒体的蛋白翻译过程和内嵴结构,抑制谷氨酸的合成,进而加速大脑衰老和阿尔茨海默病的病理进程。该项研究对理解大脑衰老与阿尔茨海默病的发病机制具有重要意义,揭示了tRNA片段在大脑衰老中的全新作用,并且提出了延缓认知衰退的治疗新思路。
中国科学技术大学特任副研究员李定丰为论文的第一作者,刘强教授为论文的通讯作者。本研究也得到了中国科学技术大学申勇教授,薛天教授,汪铭教授的大力支持,以及实验中心任继树和施荣华两位老师的帮助。
原文链接:https://doi.org/10.1016/j.cmet.2024.02.011
参考文献:
1. Satoh, A., Imai, S. I., & Guarente, L. (2017). The brain, sirtuins, and ageing. Nature reviews. Neuroscience. 18(6), 362–374.
2. Reddy, P. H., & Beal, M. F. (2008). Amyloid beta, mitochondrial dysfunction and synaptic damage: implications for cognitive decline in aging and Alzheimer's disease. Trends. Mol. Med. 14(2), 45–53.
3. Daum, B., Walter, A., Horst, A., Osiewacz, H. D., & Kühlbrandt, W. (2013). Age-dependent dissociation of ATP synthase dimers and loss of inner-membrane cristae in mitochondria. Proc. Natl Acad. Sci. USA. 110(38), 15301–15306.
4. Hou, Y., Dan, X., Babbar, M., Wei, Y., Hasselbalch, S. G., Croteau, D. L., & Bohr, V. A. (2019). Ageing as a risk factor for neurodegenerative disease. Nature reviews. Neurology, 15(10), 565–581.
5. Li, D., Zhang, J., & Liu, Q. (2022). Brain cell type-specific cholesterol metabolism and implications for learning and memory. Trends in neurosciences, 45(5), 401–414.
6. Moreira, P. I., Carvalho, C., Zhu, X., Smith, M. A., & Perry, G. (2010). Mitochondrial dysfunction is a trigger of Alzheimer's disease pathophysiology. Biochimica et biophysica acta, 1802(1), 2–10.