
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肥胖中IgG堆积驱动胰岛素抵抗和慢性炎症
【字体: 大 中 小 】 时间:2024年12月27日 来源:北京大学基础医学院
编辑推荐:
2024年12月13日,北京大学基础医学院的强力教授研究团队与汪丽恒教授团队合作,在Cell Metabolism期刊上发表题为 “FcRn-dependent IgG accumulation in adipose tissue unmasks obesity pathophysiology” 的研究论文
肥胖,做为一种慢性疾病的潜在诱因,已成为全球范围内导致可预防性死亡的第二大因素,给医疗系统带来了沉重的负担。肥胖最明显的特征是脂肪组织扩增,并引起标志性病变,如胰岛素抵抗和慢性炎症,进而损害脂肪组织的功能和全身代谢稳态。然而,这些基础病理变化如何在肥胖状态下相互作用并加剧病情,至今仍是一个未解之谜。
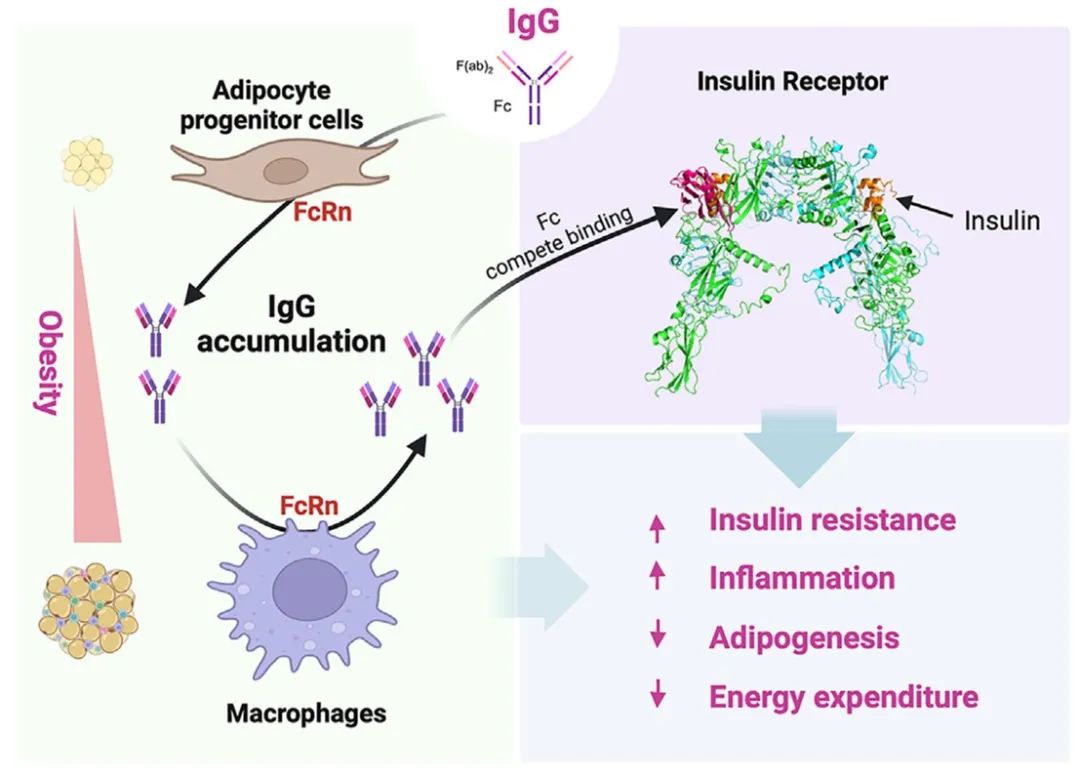
免疫球蛋白G(IgG)是我们全身最主要的适应性免疫分子,处在免疫防御的第一线,约占抗体总量的80%。2024年12月13日,北京大学基础医学院的强力教授研究团队与汪丽恒教授团队合作,在Cell Metabolism期刊上发表题为 “FcRn-dependent IgG accumulation in adipose tissue unmasks obesity pathophysiology” 的研究论文。该研究发现,IgG在肥胖发生中特异性堆积在脂肪组织中,诱发脂肪组织炎症,导致胰岛素抵抗和代谢紊乱。更出乎意料的是,IgG与胰岛素受体(IR)直接相互作用,阻碍了胰岛素的结合,是一个胰岛素受体的天然抑制因子,损害脂肪细胞生成和代谢功能。通过构建细胞特异性敲除小鼠模型和反义寡核苷酸链(ASO)干预IgG的积累,可以显著改善肥胖中脂肪组织病理改变,纠正代谢功能障碍。

该研究首先发现,小鼠在高脂饮食喂养诱导肥胖后,IgG在脂肪组织中上调了近16倍,远高于在血清和其他组织的堆积。相反,其他主要抗体IgA和IgM并无明显增加。在肥胖人群的脂肪组织中也检测到了同样的IgG堆积。巨噬细胞浸润被认为是肥胖中脂肪组织慢性炎症的标志性事件。但是,巨噬细胞浸润发生的较晚,如在小鼠高脂喂养8周后才明显。与之相反,IgG在脂肪组织中的堆积在高脂喂养2周就已经显著。这说明IgG在脂肪组织中的特异堆积是肥胖中的一个早期事件,或参与了代谢紊乱的发生发展。
在健康(瘦)小鼠中给予外源的IgG,模拟在肥胖中的上升,就能够在不肥胖的情况下,引起巨噬细胞浸润脂肪组织,诱导全身胰岛素抵抗。这说明IgG有直接导致慢性炎症和代谢紊乱的作用。有意思的是,急性IgG处理24小时就能引起显著的胰岛素抵抗,提示IgG可能直接作用于胰岛素信号通路。研究人员通过细胞膜分离、蛋白临近标记等技术发现IgG和胰岛素受体之间存在相互作用。进一步通过机器学习模型预测、微量热涌动、表面等离子共振,以及细胞功能实验揭示,IgG能够通过其Fc结构域与胰岛素竞争性地结合胰岛素受体的同一区域,抑制了受体的激活。经典的免疫学通路是IgG与抗原结合,形成免疫复合体,启动下游抗体反应。如果IgG通过Fc结构域与胰岛素受体结合,那么就应该与抗原识别无关。去除IgG的抗原识别区(Fab)证实了这一猜想,IgG-Fc可以同样抑制胰岛素信号和脂肪细胞的生成。以上结果揭示IgG是一个胰岛素受体的天然抑制因子,可能在生理水平通过缓冲作用控制胰岛素信号的过度激活,而在肥胖情况下的过度积累则诱导了胰岛素抵抗和炎症的发生。
肥胖能够诱导产生IgG的B细胞在脂肪组织中浸润。然而,脂肪组织中IgG的堆积是不依赖于B细胞的。在B细胞缺陷造成的IgG空白小鼠中注射外源的IgG,同样可以导致在脂肪组织中的特异堆积,说明脂肪组织存在富集IgG的特殊机制。事实上,IgG在体内的水平不取决于B细胞产生IgG的速率,而取决于回收受体FcRn介导的回收。已知在所有抗体中,只有IgG具有这种回收机制,因此具有最长的半衰期。在脂肪前体细胞和巨噬细胞中分别敲除FcRn,可以显著抑制IgG在肥胖的早期和晚期在脂肪组织中的堆积,从而改善代谢健康。
接下来研究人员测试了干预IgG改善肥胖中代谢功能障碍的可能性。考虑到通过干预B细胞途径可能会影响抗体的产生,造成免疫缺陷,研究人员基于上述发现FcRn回收介导的堆积机制,巧妙通过靶向FcRn来避免IgG的过度堆积,而不损伤其产生过程。在巨噬细胞中敲除FcRn, 可以抑制高脂喂养引起的肥胖和胰岛素抵抗,以及慢性炎症和代谢紊乱。进而设计抑制FcRn的反义核苷酸(ASO),也可以显著改善肥胖小鼠的代谢功能。
该研究团队在2024年2月份在Cell Metabolism首次报道了IgG是一个衰老因子,在衰老早期就率先在脂肪组织中开始堆积,驱动代谢衰退 [1]。做为衰老研究的姊妹篇,本项肥胖研究再次刷新了人们对IgG的认知,不仅揭示它是肥胖中一个新病理生理机制,还鉴定它是胰岛素受体的一个天然抑制因子,通过不依赖于抗原识别的功能发挥作用。综上所述,这项工作与前期工作互相印证,将IgG的重要作用开拓到了衰老和代谢,还提供了一个衰老和肥胖的统一机制,为综合干预,延长健康生命周期开启了新思路。
北京大学强力教授和汪丽恒教授为本研究的共同通讯作者;于乐祥博士为本文第一作者。强力教授任职于北京大学基础医学院药理学系,主要从事代谢和衰老相关的机制研究和转化探索。汪丽恒教授系北京大学心血管所研究员,主要从事代谢疾病的免疫转录调控机制的相关研究。
两课题组现招收博士后若干名,欢迎感兴趣的应届博士生发邮件联系:
强力教授
qiang@pku.edu.cn
汪丽恒教授
lihengwang@hsc.pku.edu.cn
原文链接:
https://www.cell.com/cell-metabolism/abstract/S1550-4131(24)00447-9
作者:梁冬阳
 生物通微信公众号
生物通微信公众号
知名企业招聘