
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道共生菌Faecalibacterium prausnitzii的代谢产物丁酸通过 HDAC-JAK-STAT 轴抑制NK/T细胞淋巴瘤
【字体: 大 中 小 】 时间:2024年12月26日 来源:华中科技大学生命与科学技术学院
编辑推荐:
12月9日,生命学院陈卫华和郑州大学第一附属医院李兆明/张明智团队在 Gut 杂志上发表了题为“Butyrate-producing Faecalibacterium prausnitzii suppresses natural killer/T-cell lymphoma by dampening the JAK-STAT pathway”的研究论文 [7]
NK/T细胞淋巴瘤(Natural killer/T-cell lymphoma, NKTCL)是一种高度侵袭性的淋巴瘤亚型,主要影响亚洲和南美洲人群[1]。管目前有许多新的治疗策略,但NKTCL患者的治疗结局仍然有待进一步提升,特别是对于在一线非蒽环类药物治疗后复发或进展的患者,中位总生存期仅6.4个月,中位无进展生存期仅4.1个月[2]。并且由于其不典型的临床表现,患者的及时诊断和治疗面临着巨大挑战[3]。
肠道菌群在维系人体健康中扮演着重要作用,菌群失调往往与多种疾病的发生发展密切相关[4]。近年来,越来越多的研究证据表明“微生态-肠道-淋巴瘤”轴是淋巴瘤患者十分有希望的临床干预机会[5]。此外,既往的研究结果表明肠道菌群以作为NKTCL的非侵入性诊断和预后生物标志物[6]。然而,作为一种高度恶性的淋巴瘤亚型,NKTCL患者的肠道菌群特征及其潜在应用价值仍不清楚。
12月9日,生命学院陈卫华和郑州大学第一附属医院李兆明/张明智团队在Gut杂志上发表了题为“Butyrate-producing Faecalibacterium prausnitzii suppresses natural killer/T-cell lymphoma by dampening the JAK-STAT pathway”的研究论文[7]。该研究揭示了肠道F. prausnitzii对NKTCL患者潜在的保护作用及其作用机制。其中,肠道F. prausnitzii代谢物丁酸能够显著增强肿瘤细胞SOCS1基因启动子区域组蛋白的乙酰化水平并促进该基因的表达,抑制NKTCL中高度激活的JAK-STAT通路,从而有效地抑制NKTCL的发展。这项研究为利用肠道F. prausnitzii的治疗潜力来改善这种恶性肿瘤提供了全新的视角。

为了揭示NKTCL患者的肠道菌群特征,研究人员对NKTCL患者以及匹配的健康个体的粪便样本进行了宏基因组测序。结果表明,与健康对照相比,NKTCL患者具有明显减低的α多样性以及增加的β多样性。在物种组成方面,多种肠道共生菌在NKTCL患者中显著减低,其中产丁酸菌F. prausnitzii丰度减低与NKTCL患者较差的生存结局密切相关,并在韩国的一项NKTCL队列中得到证实。
为了明确肠道F. prausnitzii对NKTCL发展的作用,通过构建NKTCL荷瘤小鼠模型,研究者们发现肠道F. prausnitzii增补能够显著抑制NKTCL的发展。代谢组学分析以及一系列体内外研究结果表明F. prausnitzii代谢物丁酸是介导这一肿瘤抑制作用的关键分子。机制上,研究人员发现丁酸能够显著增强NKTCL肿瘤细胞SOCS1基因启动子区域组蛋白的乙酰化水平并促进该基因的表达,进而抑制NKTCL中高度激活的致癌JAK-STAT通路,抑制肿瘤的发展。
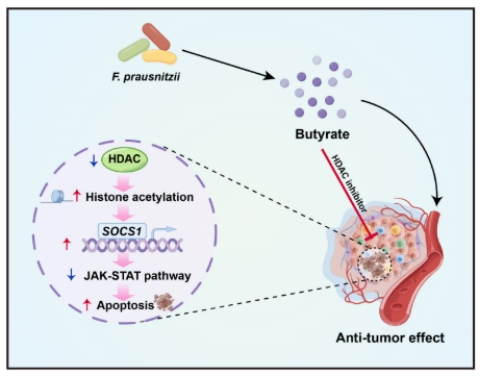
综上,这项研究首次揭示了NKTCL患者的肠道菌群特征,并指出肠道F. prausnitzii对NKTCL患者潜在的保护作用。同时,通过一系列体内外实验证明了F. prausnitzii能够通过其代谢物丁酸发挥肿瘤抑制作用,为NKTCL患者的治疗提供了新的策略。
郑州大学第一附属医院博士研究生时壮壮、华科大生命科学与技术学院博士研究生李敏为论文的共同第一作者。郑州大学第一附属医院李兆明教授、张明智教授、华科大生命科学与技术学院陈卫华教授为共同通讯作者。本课题受到国家自然科学基金等经费资助。
近年来,陈卫华教授团队致力于肠道菌群与疾病关系研究,并以此指导对疾病的精准干预。在相关领域取得系统成果,包括:(1) 构建肠道菌群与疾病关系数据库,收集131种疾病,鉴定500多种疾病标志菌(Nucleic Acids Research,2020,2022);(2) 基于肠道菌群,构建了多种疾病的诊断机器学习模型,并利用独立队列对模型性能进行评估(Gut microbes,2023);(3) 与郑州大学第一附属医院合作,解析了 NKT 肿瘤的肠道菌群特征(Gut,2023),利用动物模型阐明了菌群影响肿瘤的机制,提出可能的干预方案(Gut,本作); (4) 联合生命学院、华中科技大学同济医院,鉴定了一株促进肝癌患者术后恢复的有益菌,并通过临床试验验证其功效(Cell Host & Microbe,2024)。
文章链接:https://gut.bmj.com/content/early/2024/12/05/gutjnl-2024-333530.long
参考文献:
1. Wang, H., et al., NK-/T-cell lymphomas. Leukemia, 2021. 35(9): p. 2460-2468.
2. Tse, E., et al., How we treat NK/T-cell lymphomas. J Hematol Oncol, 2022. 15(1): p. 74.
3. Tse, E. and Y.L. Kwong, Recent Advances in the Diagnosis and Treatment of Natural Killer Cell Malignancies. Cancers (Basel), 2022. 14(3).
4. de Vos, W.M., et al., Gut microbiome and health: mechanistic insights. Gut, 2022. 71(5): p. 1020-1032.
5. Shi, Z. and M. Zhang, Emerging Roles for the Gut Microbiome in Lymphoid Neoplasms. Clin Med Insights Oncol, 2021. 15: p. 11795549211024197.
6. Shi, Z., et al., Gut microbiota as non-invasive diagnostic and prognostic biomarkers for natural killer/T-cell lymphoma. Gut, 2023. 72(10): p. 1999-2002.
7. Shi, Z., et al., Butyrate-producing Faecalibacterium prausnitzii suppresses natural killer/T-cell lymphoma by dampening the JAK-STAT pathway. Gut, 2024.
 生物通微信公众号
生物通微信公众号
知名企业招聘