
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Molecular Cell∣王嘉东/王维斌团队揭示清除复制叉特异性RNA克服肿瘤化疗耐药的新策略
【字体: 大 中 小 】 时间:2024年12月21日 来源:北京大学医学部
编辑推荐:
2024年12月19日,北京大学医学部王嘉东课题组与王维斌课题组合作在Molecular Cell杂志在线发表了题为DDX39A Resolves Replication Fork-associated RNA-DNA Hybrids to Balance Fork Protection and Cleavage for Genomic Stability Maintenance的研究论文
2024年12月19日,北京大学医学部王嘉东课题组与王维斌课题组合作在Molecular Cell杂志在线发表了题为DDX39A Resolves Replication Fork-associated RNA-DNA Hybrids to Balance Fork Protection and Cleavage for Genomic Stability Maintenance的研究论文。该研究首次鉴定出RNA-DNA杂合体(Replication Fork-associated RNA-DNAs, RF-RDs)作为转录活跃区停滞复制叉的重要保护因子,揭示了一种独立于RAD51的复制叉保护机制,并提出靶向清除RF-RDs可能成为克服肿瘤化疗耐药的新策略。

在肿瘤细胞中,许多基因处于高度转录活跃状态,这种高水平的转录活动为肿瘤的快速增殖提供了动力,但也给DNA复制带来了严峻挑战。RNA转录和DNA复制共享同一DNA模板,RNA聚合酶的活动可能干扰复制叉的正常行进,进而引发复制叉停滞。若复制叉未能得到及时的保护,可能会触发转录活跃区域的DNA损伤、断裂及基因组不稳定。为了在这种高转录压力下维持基因组稳定,肿瘤细胞发展出一系列复杂的机制来协调转录和复制的相互作用,避免复制叉的过度停滞与损伤。因此,破解肿瘤细胞如何在维持高转录活性的同时保持基因组稳定,已成为癌症治疗中的关键挑战。
研究团队首先开发了“复制叉RNA捕获”(Replication Fork RNA Capture, REFORC)技术,分离复制叉结合的RNA。通过高通量测序进行分析发现,复制压力可以诱导肿瘤细胞在转录活跃区域产生大量复制叉RNA-DNA杂合体RF-RDs。RF-RDs的形成依赖于RNA聚合酶Ⅱ的转录活性,RNA-DNA特异性核酸酶RNase H的处理能够显著减少RF-RDs的水平。这表明RF-RDs是肿瘤细胞在转录活跃区域复制压力响应的重要产物。
随后研究团队研究发现抑制RF-RDs会导致复制叉新生DNA的降解,并显著增加DNA末端切割和DNA断裂的发生。进一步体外生化实验和细胞实验表明,RF-RDs能够抑制核酸酶DNA2的核酸酶活性,从而减缓DNA2对复制叉的降解。研究团队进一步通过全基因组测序发现,在RF-RDs减少的染色质区域,复制压力下会产生更多的基因突变,表明RF-RDs在生理层面具有避免转录活跃区基因突变的重要功能。
研究进一步揭示了RF-RDs的形成与解除的动态调控机制。研究团队鉴定了RNA解旋酶DDX39A具有RNA-DNA解旋活性,能够促进RF-RDs的解除。在复制压力下,DDX39A通过RAD51的招募作用,定位于停滞的复制叉,解旋RF-RDs并促进DNA2介导的复制叉重启。缺失DDX39A的细胞不能有效解除RF-RDs,表现出复制叉重启缺陷和自发DNA损伤,完全缺失DDX39A会导致小鼠胚胎致死。
研究还发现,DDX39A低表达导致BRCA2缺陷的细胞RF-RDs水平升高,复制叉稳定性增强,使BRCA2缺陷肿瘤细胞对化疗产生抗性,进而与BRCA2缺陷肿瘤患者的不良预后相关。重要的是,研究团队还发现铂类耐药肿瘤中RF-RDs的水平较高,通过CDK9抑制剂和BRD4抑制剂可以消除RF-RDs并逆转肿瘤化疗耐药,因此靶向清除RF-RDs具有重要的临床转化价值。
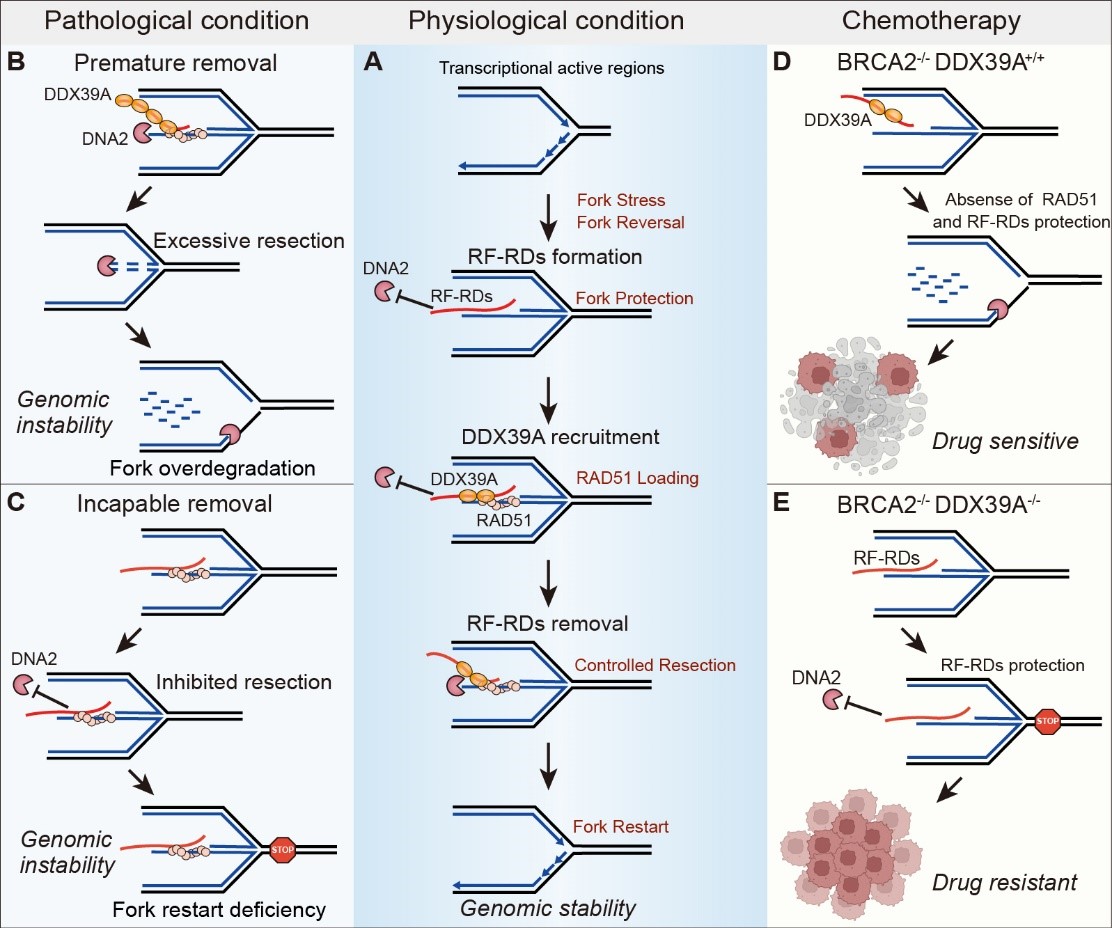
该研究揭示了RF-RDs在转录活跃区复制叉稳定和肿瘤化疗耐药中的关键作用,并阐明了RNA解旋酶DDX39A在调控RF-RDs中的核心功能。这项发现不仅为保持转录活跃区DNA复制叉的稳定性提供了新见解,提出RF-RDs为转录活跃区停滞复制叉独立于RAD51的重要保护因子,还为提高铂类药物耐药肿瘤的化疗效果提供了有力的科学依据和干预策略。
北京大学基础医学院博士后徐战战和博士后聂臣为论文的共同第一作者,王嘉东教授与王维斌副研究员为论文的共同通讯作者。王嘉东课题组的博士研究生廖军威,以及麻宇颉博士和周筱博士等人也为该论文做出了重要贡献。该研究得到国家杰出青年基金、国家自然科学基金重点项目、科技部重点研发计划等资助。