
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature Communications | 中国科大黄成栋团队揭示Hsp90动态机制的原子分辨率图景
【字体: 大 中 小 】 时间:2024年12月12日 来源:中国科学技术大学 | 生命科学与医学部
编辑推荐:
2024 年 12 月 11 日,中国科学技术大学生命科学与医学部黄成栋教授团队在《 Nature Communications 》期刊发表了题为《 The Dynamic Triage Interplay of Hsp90 with its Chaperone Cycle and Client Binding 》的研究论文
2024年12月11日,中国科学技术大学生命科学与医学部黄成栋教授团队在《Nature Communications》期刊发表了题为《The Dynamic Triage Interplay of Hsp90 with its Chaperone Cycle and Client Binding》的研究论文。该研究利用液体核磁共振(NMR)技术,首次在原子分辨率上解析了Hsp90在ATP循环中的多层次动态机制,揭示了构象转换、底物结合与能量屏障调控之间的协同关系。这些发现为深入理解分子伴侣Hsp90的作用机制以及其在抗癌药物开发中的潜力提供了重要理论依据。
热休克蛋白90(Hsp90)是细胞内的一种关键分子伴侣,负责调控超过10%的人类蛋白质组,包括激酶、E3连接酶和转录因子等多种重要蛋白。作为细胞信号传导和蛋白质稳态维持的核心因子,Hsp90也是癌症研究中的重要分子靶点。然而,Hsp90动态机制的复杂性使科学界对其作用机制的理解仍然不够深入。
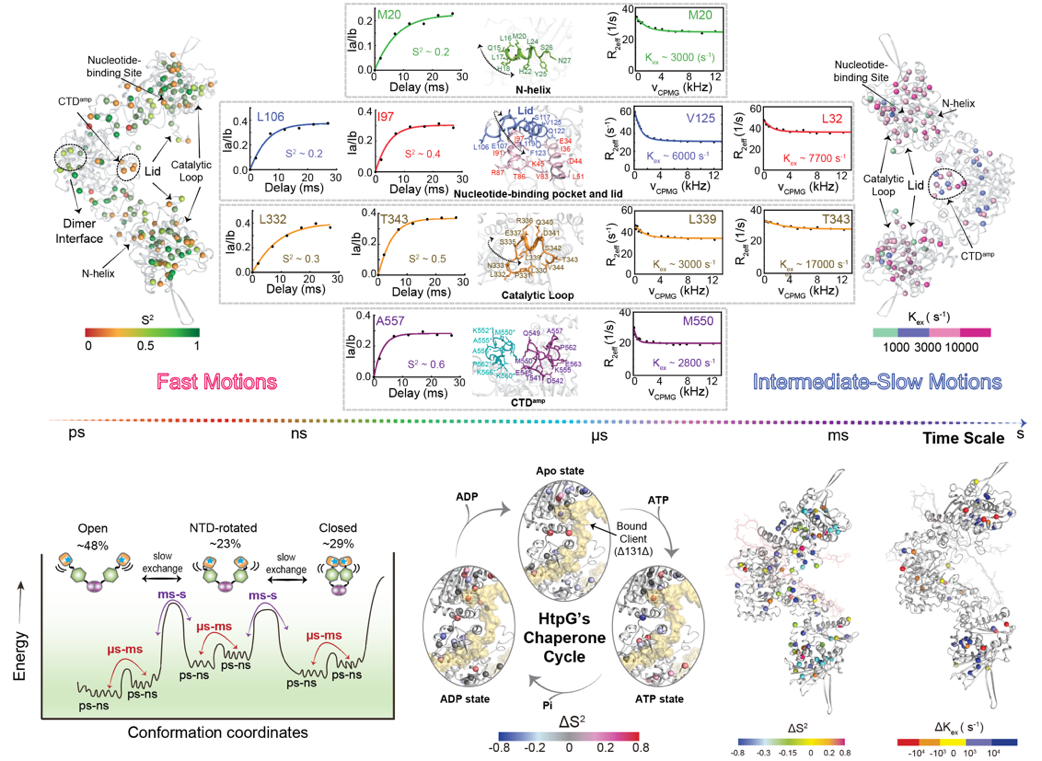
图1:分子伴侣HtpG在其ATP水解循环中不同阶段的动态及构象变化
本研究以大肠杆菌的Hsp90(HtpG)为研究体系,利用液体核磁共振技术,在原子分辨率上系统解析了HtpG溶液中的构象动态。研究表明,HtpG在ATP结合后,能够在多种构象之间实现动态平衡,并经历从‘开放’到‘闭合’的构象转换;而ATP水解进一步推动其进入一种更加稳定且紧凑的构象状态。值得注意的是,课题组之前的研究已揭示,在ATP赋能的循环过程中,HtpG如同一个灵活精密的‘纳米机械夹钳’,通过周期性开合发挥作用(NSMB, 2024)。本工作进一步深化了对该过程的理解,揭示了HtpG在循环各阶段不仅表现出截然不同的构象状态,每种状态还具有独特的动态特性。这种多层次、多阶段的动态调控机制,使HtpG能够高效介导底物蛋白的折叠与活化(图1)。
研究进一步揭示,HtpG在与底物蛋白结合时,通过局部结合的特异性相互作用激发了分子伴侣的‘全局动态联动’机制。这一机制将局部交互信号传递至全分子的其他区域,显著降低了HtpG从一种构象转变到另一种功能性构象的能量屏障。同时,这种联动作用改变了构象热力学平衡,并延长了HtpG支持底物蛋白折叠与活化的时间窗口(图2)。
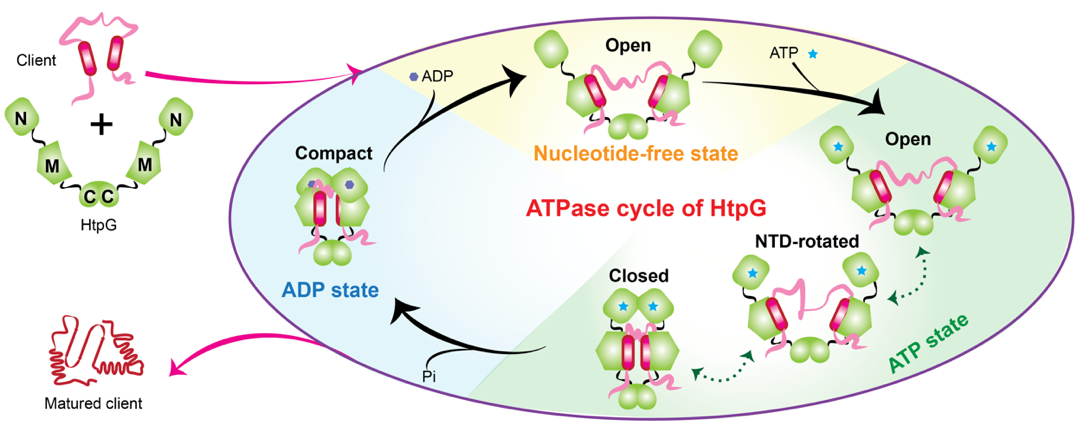
图2:Hsp90的功能机制示意图
该工作深化了对分子伴侣Hsp90动态功能机制的理解,并为以该分子伴侣为靶点的抗癌药物开发提供了理论依据。通过首次在原子分辨率揭示大型分子伴侣在不同时间跨度下的构象变化,该研究展示了液体NMR技术在解析复杂动态分子机器中的巨大潜力。
本研究由中国科学技术大学博士研究生屈晓展为第一作者,黄成栋教授和许威亚副研究员为共同通讯作者。项目得到了国家自然科学基金委员会、科技部、无膜细胞器与细胞动力学教育部重点实验室、合肥综合性国家科学中心大健康研究院等机构的资助。核磁共振的部分实验在中科院合肥物质科学研究院强磁场中心完成。
原文链接:https://www.nature.com/articles/s41467-024-55026-y