
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命科学学院李湘盈课题组发现促进红系增殖及改善贫血的新靶点
【字体: 大 中 小 】 时间:2024年12月12日 来源:北京大学新闻网
编辑推荐:
该研究发现,原本用于治疗BRAFV600E肿瘤的BRAF抑制剂,能够显著促进人原代CD34+细胞分化系统中的红系祖细胞和红系前体细胞增殖,从而为贫血的治疗提供了新的思路。
红细胞生成是维持机体正常生理活动和血液系统正常功能的重要过程。红细胞生成异常往往会导致贫血,并与多种遗传性疾病密切相关。然而,目前用于治疗贫血的药物选择极为有限。例如,先天性再生障碍型贫血(如Diamond-Blackfan贫血,DBA)临床上唯一获批的治疗药物为糖皮质激素,但其使用伴随显著的免疫抑制等副作用。因此,迫切需要开发更高效且更安全的治疗方案1,2。
2024年12月2日,北京大学生命科学学院、北大-清华生命科学联合中心、北京大学血液病研究所李湘盈课题组在Signal Transduction and Targeted Therapy期刊上发表了题为“BRAF inhibitors enhance erythropoiesis and treat anemia through paradoxical activation of MAPK signaling”的研究论文。该研究发现,原本用于治疗BRAFV600E肿瘤的BRAF抑制剂,能够显著促进人原代CD34+细胞分化系统中的红系祖细胞和红系前体细胞增殖,从而为贫血的治疗提供了新的思路。
在研究中,作者建立了基于人原代CD34+细胞的高通量小分子筛选策略,并通过该策略发现BRAF抑制剂能够显著促进红系祖细胞自我更新,提升红系增殖潜力。进一步研究表明,I型BRAF抑制剂GDC-0879和SB-590885显著促进了人原代红系祖细胞的增殖;在SCF或EPO受限的条件下,显著增强了红系分化。通过胞内流式和质谱分析,作者证实了BRAF抑制剂在细胞因子存在的情况下,通过诱导BRAF和CRAF二聚,显著放大了ERK/MAPK信号激活强度,即“BRAF抑制剂诱导的ERK/MAPK矛盾激活”3,4。
为了探究这种矛盾激活的独特机制,研究团队比较了BRAF抑制剂和BRAFV600E突变引起的MAPK激活。结果显示,BRAFV600E突变体的过表达会导致CD34+细胞干性丧失和红系分化障碍,这与BRAF抑制剂截然不同。一系列RNA-seq和ATAC-seq分析表明,BRAFV600E突变显著激活了AP-1信号通路,进而阻碍红系分化;而BRAF抑制剂并未诱导该通路激活。以上结果表明了de novo的ERK激活和药理学介导的ERK信号放大最终导致了截然不同的下游细胞生物学事件,显示出BRAF抑制剂独特的作用机制。
研究人员在2种重度免疫缺陷小鼠模型中,通过人CD34+细胞骨髓移植实验重建了人类造血系统,进一步验证了BRAF抑制剂的体内效应。实验结果表明,BRAF抑制剂显著增强了红系分化和增殖,而对其他造血谱系影响较小。更重要的是,在DBA患者样本以及Rpl11单倍剂量不足小鼠(DBA小鼠模型)和顺铂诱导贫血模型中,BRAF抑制剂均表现出对红系增殖的显著促进作用,尤其在改善DBA贫血方面效果突出。
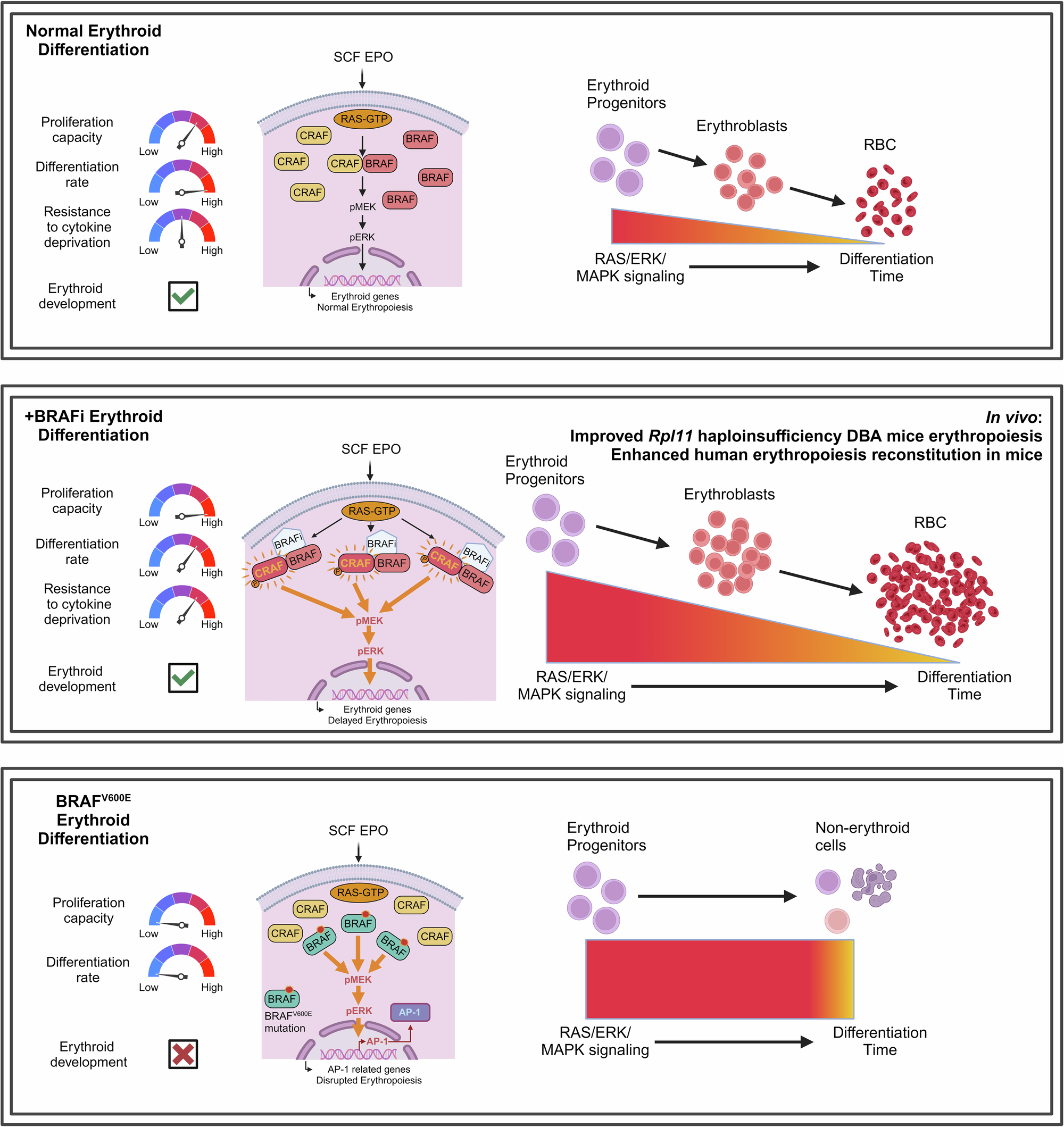
BRAF V600E突变显著激活了AP-1信号通路,进而阻碍红系分化;BRAF抑制剂通过MAPK信号的矛盾激活增强红细胞生成并可缓解贫血
综上所述,本研究不仅揭示了BRAF抑制剂的全新药理作用,还为红细胞生成障碍相关疾病的治疗提供了新靶点和新药物选择。鉴于已有多种BRAF抑制剂(如Vemurafenib和Encorafenib)获批上市,这一发现对临床治疗贫血,尤其是DBA等先天红系生成障碍性贫血,以及开发新型贫血药物具有重要意义。
李湘盈,西湖大学研究员高晓飞以及浙江省人民医院教授童向民为本文共同通讯作者。北京大学人民医院、北京大学血液病研究所教授黄晓军,北京大学化学与分子工程学院教授雷晓光合作参与完成了这一工作,并给予了大力支持。北京大学生命科学学院2020级博士生吴顺康和2021级博士生邓悦林为论文的共同第一作者,西湖大学生命科学学院博士孙浩博和刘雪雯为研究作出了重要贡献,北京大学生命科学学院博士生周硕等人亦提供了关键帮助。本研究获得国家自然科学基金和北京大学生命科学学院启东产业创新基金的资助,同时得到了北大生命科学学院仪器中心的技术支持。
参考文献
1.Lee, H. Y. et al. PPAR-alpha and glucocorticoid receptor synergize to promote erythroid progenitor self-renewal. Nature 522, 474—477, (2015).
2.Da Costa, L., Leblanc, T. & Mohandas, N. Diamond-Blackfan anemia. Blood 136, 1262—1273, (2020).
3.Karoulia, Z. et al. An Integrated Model of RAF Inhibitor Action Predicts Inhibitor Activity against Oncogenic BRAF Signaling. Cancer Cell 30, 501—503, (2016).
4.Gibney, G. T., Messina, J. L., Fedorenko, I. V., Sondak, V. K. & Smalley, K. S. M. Paradoxical oncogenesis-the long-term effects of BRAF inhibition in melanoma. Nature Reviews Clinical Oncology 10, 390—399, (2013).