
-

生物通官微
陪你抓住生命科技
跳动的脉搏
清华大学基础医学院刘锦涛团队揭示细菌群体耐受噬菌体新机制
【字体: 大 中 小 】 时间:2024年12月07日 来源:清华大学医学院
编辑推荐:
2024年 9 月 4 日,清华大学基础医学院 刘锦涛课题组 在 Science Advances 杂志上发表了题为 “ Essential phage component induces resistance of bacterial community ” (噬菌体必要元件导致细菌群体抗性)的论文

由于抗生素耐药问题日益加重,噬菌体疗法近年来受到越来越多的关注。不同于抗生素,少量噬菌体即可清除大量细菌。此外,噬菌体对细菌具有高度的特异性,给定噬菌体通常仅感染某些菌株,因此噬菌体疗法能够有效避免对人体共生菌的影响。目前,大多噬菌体研究基于浮游状态的细菌。然而,临床上很多感染由细菌生物被膜引起。与游离态细菌相比,生物被膜常表现出更强的抗性,我们对其抗性机制的理解还不够充分。
2024年9月4日,清华大学基础医学院刘锦涛课题组在Science Advances杂志上发表了题为“Essential phage component induces resistance of bacterial community”(噬菌体必要元件导致细菌群体抗性)的论文。该工作对噬菌体侵染细菌生物被膜的动态过程进行了定量研究,发现细菌在被噬菌体裂解时释放出大量未组装至噬菌体的尾纤维蛋白,这些蛋白导致生物被膜对噬菌体产生抗性。
研究者以肺炎克雷伯菌生物被膜为模式系统,发现在噬菌体感染初期,生物被膜的外围区域能够被噬菌体有效裂解(图1)。然而,仅10小时后,生物被膜就对噬菌体产生了抗性并恢复生长(图1)。新长出的细菌从生物被膜中提取出来后依旧对噬菌体敏感,表明该现象并非由常见的细菌突变所导致,而是生物被膜产生的群体抗性。
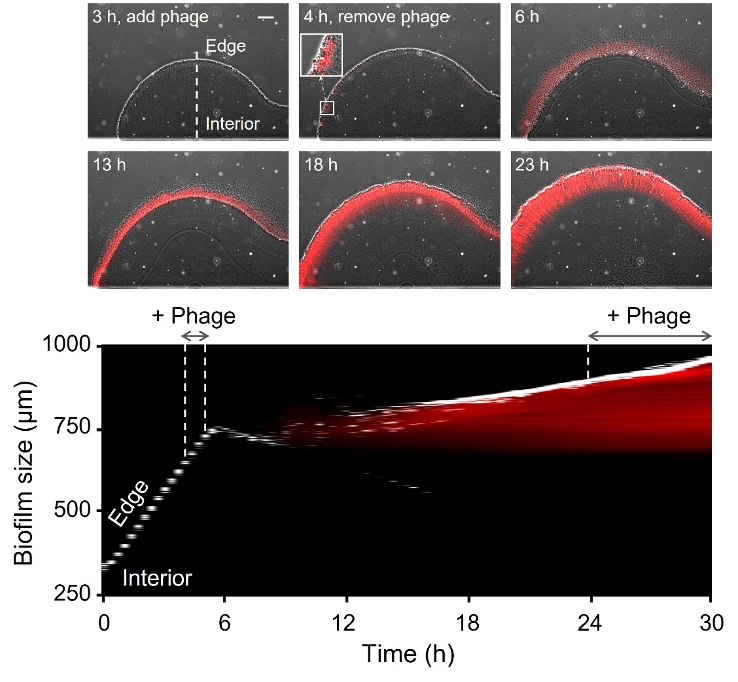
图1. 噬菌体侵染生物被膜的动态过程
红色荧光表征细菌死亡
研究者发现,噬菌体侵染导致生物被膜中产生一条亮带,该亮带不断向生物被膜内部移动(图2)。研究者进一步发现,该亮带由噬菌体尾纤维蛋白导致。该蛋白能够特异性的识别并降解细菌表面的荚膜多糖,且该蛋白可导致生物被膜对噬菌体产生抗性。
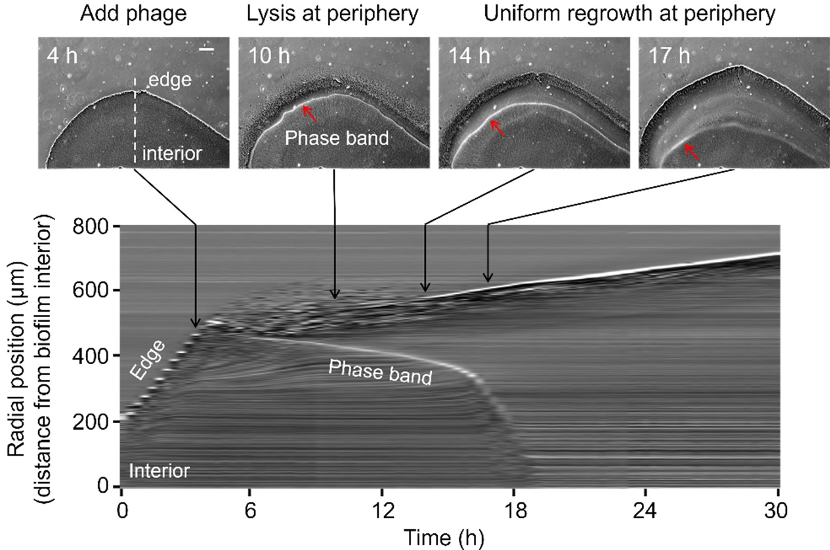
图2. 噬菌体导致生物被膜中出现向内移动的亮带
研究者提出以下机制(图3):噬菌体首先感染生物被膜的外围区域,并裂解外围的细菌。被裂解的细菌除释放出新复制的噬菌体外,还会释放出未组装至噬菌体的尾纤维蛋白。这些游离的蛋白能够先于噬菌体扩散至生物被膜内部,并在扩散的过程中降解细菌表面的荚膜多糖。由于荚膜多糖是很多噬菌体感染细菌所必需的受体,上述过程导致生物被膜对噬菌体产生抗性。研究者进一步证明,改变尾纤维蛋白或荚膜多糖的表达量可以调节生物被膜对噬菌体的抗性。

图3. 生物被膜对噬菌体产生抗性的机制
该工作表明,细菌裂解物对噬菌体侵染细菌群体有重要的影响,因此应受到更多的关注。研究者还发现,噬菌体尾纤维蛋白在导致生物膜被膜产生抗性的同时,还导致其暴露出新的弱点。生物被膜具有强耐受性的一个原因是其自身建立的扩散屏障。尾纤维蛋白降解细菌荚膜导致生物大分子更容易扩散至生物被膜内部,这为开发新型噬菌体提疗法提供了可能。清华大学基础医学院刘锦涛课题组2020级博士生胡倩瑜为该论文的第一作者。清华大学基础医学院向烨教授及其博士生黄亮、杨耀宇为该课题提供了重要支持。
论文链接:
https://doi.org/10.1126/sciadv.adp5057
