
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Cell Discovery | 吴聪颖课题组报道相分离调控细胞骨架-糖酵解偶联
【字体: 大 中 小 】 时间:2024年12月04日 来源:北京大学基础医学院
编辑推荐:
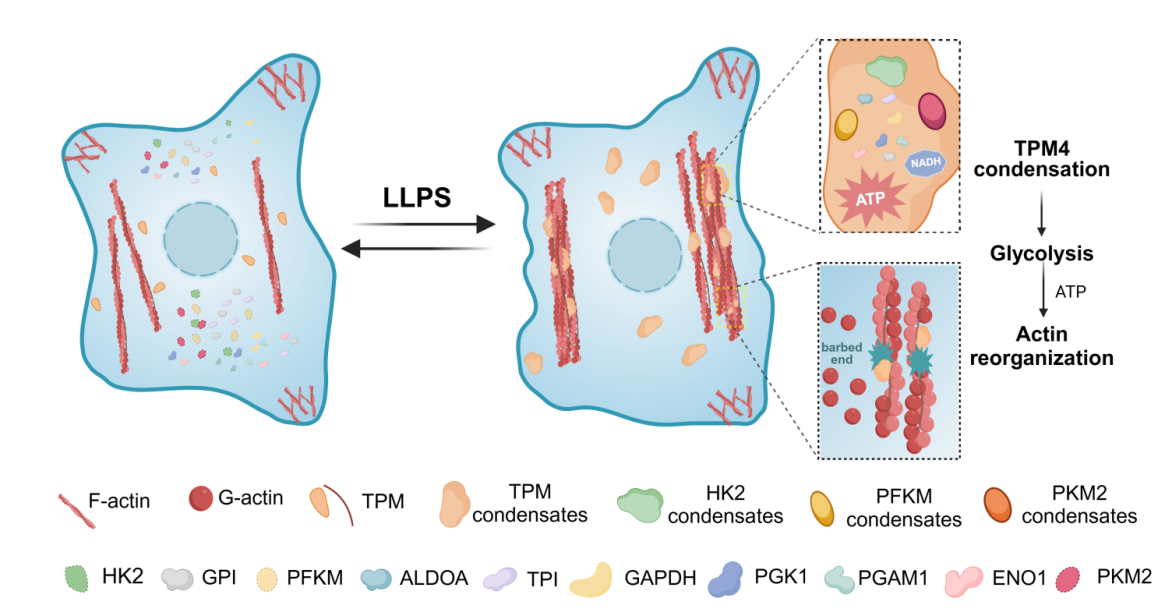
2024年12月3日,北京大学基础医学院系统生物医学研究所吴聪颖课题组Cell Discovery在线发表文章“TPM4 condensates glycolytic enzymes and facilitates actin reorganization under hyperosmotic stress”,揭示微丝结合蛋白TPM4可以发生相分离,招募多种糖酵解酶形成功能性的凝聚体,促进糖酵解的进行,并反馈促进细胞应激下的微丝骨架重排
微丝骨架具有高度动态,调控细胞增殖、分化和迁移等过程。早期文献报道,在部分细胞类型中,约50%的ATP被用于维持微丝骨架的动态平衡。细胞如何进行高效的能量代谢来满足微丝骨架重排,一直悬而未决。上个世纪七十年代多项体外生化实验证明,肌动蛋白可直接结合多种糖酵解酶,然而,细胞内微丝骨架与能量代谢的串扰和调控机制尚不明确。
2024年12月3日,北京大学基础医学院系统生物医学研究所吴聪颖课题组Cell Discovery在线发表文章“TPM4 condensates glycolytic enzymes and facilitates actin reorganization under hyperosmotic stress”,揭示微丝结合蛋白TPM4可以发生相分离,招募多种糖酵解酶形成功能性的凝聚体,促进糖酵解的进行,并反馈促进细胞应激下的微丝骨架重排。

该研究发现,高渗透压刺激时TPM4等微丝结合蛋白可以更多的定位到微丝骨架上,这一过程对微丝骨架重排有何作用?通过TurboID-MS技术,研究人员富集到糖酵解相关通路,提示微丝骨架与糖酵解间联系紧密。
研究人员进一步对TPM4调控微丝骨架和糖酵解偶联的分子机制进行探索,借助“FuzDrop”等生物信息学工具、光遗传学技术、体外蛋白质相分离和基因敲入技术,发现TPM4具有相分离能力,并能够招募多种糖酵解限速酶进入到同一凝聚体中。
功能上,借助NADH荧光探针“Peredox”和ATP荧光探针“MaLionR”,研究人员发现诱导细胞产生TPM4凝聚体后,NADH和ATP信号会集中到TPM4凝聚体内,说明凝聚体内部存在着糖酵解中间产物NADH以及ATP;细胞能量代谢分析Seahorse结果表明,TPM4相分离与糖酵解水平升高相关联;更进一步,光控诱导TPM4相分离即可促进糖酵解乳酸水平升高,支持了TPM4相分离可以促进糖酵解。与此同时,TPM4的缺失会降低高渗环境下细胞的糖酵解水平,使得微丝骨架重排受损。最后,研究人员在具有高渗压力的小鼠肾脏切片中观察到TPM4凝聚体,并且,这些凝聚体同样与糖酵解酶存在共定位,为揭示渗透压调控的生理病理机制提供新思路。
综上所述,本研究创新性地揭示了TPM4在微丝骨架和糖酵解偶联中的核心枢纽作用,证明了TPM4在应激条件下形成凝聚体,介导糖酵解酶的区室化分布,高效地为微丝骨架重排提供能量。本研究揭示了微丝骨架结合蛋白的新功能,为微丝骨架与能量代谢偶联提供了新的研究思路。
北京大学基础医学院系统生物医学研究所吴聪颖研究员为本文的通讯作者,北京大学基础医学院博士后杨文忠、王源和2019级八年制学生刘歌瑶为论文的共同第一作者。北京大学基础医学院梁令副研究员为该研究提供了重要帮助。该工作得到了国家重点研发计划、国家自然科学基金面上和青年项目以及国家资助博士后研究人员计划等经费的支持。