
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Xenium原位分析助力表征肿瘤异质性和鉴定治疗应答的生物标志物
【字体: 大 中 小 】 时间:2024年11月29日 来源:10x Genomics
编辑推荐:
Xenium原位单细胞空间成像技术让研究人员认识到,空间信息不仅有助于进一步了解免疫肿瘤学,而且其本身也可以成为一种生物标志物。基因在哪里表达、采取何种表达模式、细胞的相对位置如何、它们之间如何通讯——所有这些因素促成了肿瘤的异质性。
免疫肿瘤学研究人员面临的挑战可以归结为一点:解析肿瘤的异质性。应对这些挑战的答案就在于找到更好的生物标志物。
然而,生物标志物本身也是异质性的。尽管生物标志物通常被定义为某个组分(如基因、分析物或蛋白标志物)存在或不存在,但它们涵盖的内容远不止这些。
Xenium原位单细胞空间成像技术让研究人员认识到,空间信息不仅有助于进一步了解免疫肿瘤学,而且其本身也可以成为一种生物标志物。基因在哪里表达、采取何种表达模式、细胞的相对位置如何、它们之间如何通讯——所有这些因素促成了肿瘤的异质性,反过来,这也让空间背景成为肿瘤免疫反应、治疗应答等方面的潜在生物标志物。
非因生物(Fynn Biotechnologies)的研究人员意识到这些可能性,在一篇最近发表的预印本中(1),他们试图利用Xenium原位分析表征肿瘤异质性和鉴定治疗应答的生物标志物。通过利用大规模多重单细胞空间转录组学来分析免疫治疗时状态各异的多种乳腺癌亚型,这些研究人员能够:
解析肿瘤微环境的细胞组成并分析其空间结构
将细胞组成与空间共定位相结合,更好地鉴别乳腺癌亚型中的肿瘤微环境
鉴定细胞和分子结构,它们定义了不同乳腺癌亚型对免疫治疗的应答
利用空间限定的配体/受体作为新型的免疫治疗应答的潜在生物标志物
01 解析乳腺癌亚型的细胞组成,并验证RNA与IHC数据的对应关系
即使在癌症中,乳腺癌也有着相当高的异质性。研究人员使用Xenium Human Breast Panel,对病理和生物上多样化的四个乳腺癌样本进行转录表征。
样本包括:
两个管腔癌症,一个出现胸壁转移(LBC-Chest-Met),一个出现肺转移(LBC-Lung-Met)
一个HER2阳性和HR阴性癌症,出现淋巴结转移(HER2+/HR-LN-Met)
一个三阴性癌症,出现淋巴结转移(TNBC-LN-Met)
利用收集到的基因表达数据,研究人员根据标志物基因对细胞类型进行注释,并将其细分为主要细胞类型、免疫细胞类型和T细胞类型。他们最初从所有样本中解析出15种细胞类型,并进一步划分成预期的层级谱系(图1)。免疫细胞被分为髓系和淋巴系细胞簇,后者又被分为各种T细胞亚型,包括效应T细胞、调节T细胞、初始T细胞和自然杀伤T细胞。
乳腺癌的各个亚型显示出不同的细胞组成。淋巴结转移样本(HER2+/HR-LN-Met和TNBC-LN-Met)表现出相似的细胞组成,而管腔癌样本则明显不同。LBC-Chest-Met的肿瘤细胞含量远高于其他样本,而LBC-Lung-Met则含有较高比例的平滑肌细胞和内皮细胞。
这些初始数据提供了单细胞信息,但Xenium的真正优势在于将其与空间背景相结合。研究人员将细胞定位数据叠加到H&E染色图像上,生成了与解剖特征完美匹配的细胞图谱(图1)。
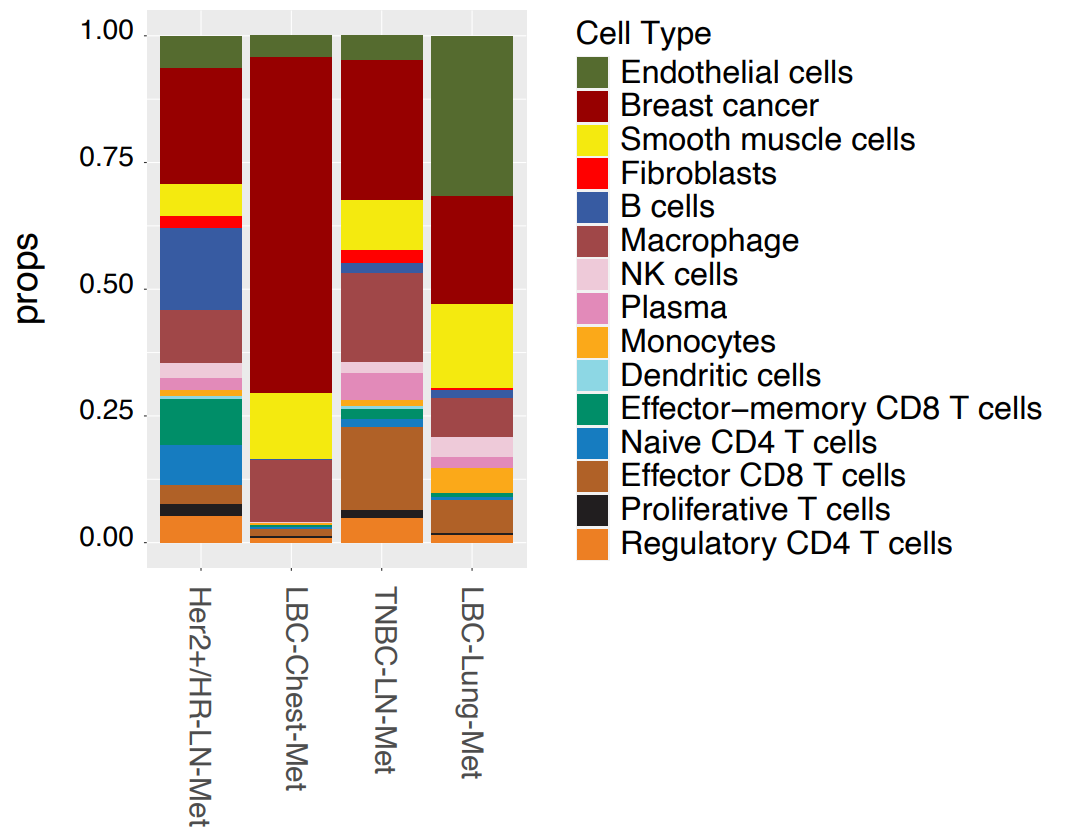
图1. 乳腺癌各个亚型中整张组织切片的细胞比例细分。图片改编自Wang等人论文中的图1B。(CC BY 4.0).
最后,使用基因表达数据时的挑战之一是RNA水平不一定与蛋白质水平相对应。为了进一步验证其数据的有效性,研究团队利用IHC比较了四个公认的组织学标志物(ESR1、PGR、ERBB2 (Her2)和MKI67 (Ki67))的RNA和蛋白质表达水平,表明不同乳腺癌亚型的RNA和蛋白质数据之间总体上对应良好。根据这些结果推断,与传统方法相比,多重的转录组学方法可以更轻松地从有限且珍贵的患者样本中获得高几个数量级的数据。
02 将细胞组成与空间共定位相结合,更好地鉴别乳腺癌亚型中的肿瘤微环境
之后,作者分析了HER2+/HR-LN-Met、TNBC-LN-Met和LBC-Chest-Met样本中的肿瘤富集区域和免疫-基质区域(ROI)的细胞组成和结构。
他们首先对肿瘤富集区域进行ROI分析。他们发现,与HER2+/HR-LN-Met和TNBC-LN-Met相比,LBC-Chest-Met ROI表现出肿瘤细胞的极度富集。有趣的是,HER2+/HR-LN-Met和TNBC-LN-Met这两个转移样本表现出多种免疫细胞和T细胞的广泛浸润。
免疫-基质区域的ROI分析将癌症分为两组:Her2+/HR-LN-Met(以B细胞和CD8 T细胞为主),LBC-Chest-Met和TNBC-LN-Met(以平滑肌、内皮细胞和巨噬细胞为主)(图2)。LBC-Chest-Met和TNBC-LN-Met中这些细胞类型的空间分布明显不同,强调了这些癌症的异质性以及空间背景的重要性。
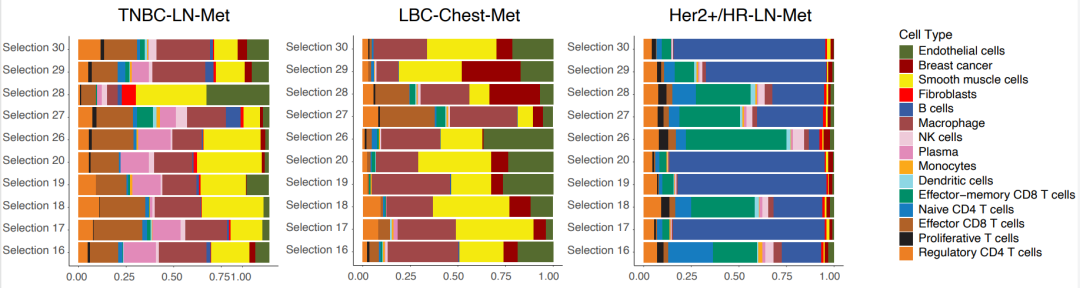
图2. 按乳腺癌亚型来划分免疫-基质ROI中的细胞组成。图片改编自Wang等人论文中的图3A。(CC BY 4.0).
接下来,作者重点关注了细胞共定位。尽管细胞组成上有一些相似之处,但每种乳腺癌亚型都表现出独特的肿瘤微环境。例如,LBC-Lung-Met表现出免疫细胞和巨噬细胞与CD8 T细胞的强烈共定位,而在LBC-Chest-Met中,癌细胞则主要与B细胞相互作用。
总的来说,这些数据不仅凸显了癌症在细胞组成上的异质性,还强调了解这些细胞类型如何相互作用的重要性,有助于更好地了解不同乳腺癌亚型的肿瘤微环境。
03 细胞和分子结构决定了不同乳腺癌亚型的治疗应答
免疫细胞在肿瘤中如何排布,可能会影响免疫检查点抑制剂(ICI)等抗癌疗法的效果。为了了解这种现象是如何发生的,作者分析了曾经接受抗PD-1治疗的患者,并比较了应答者和无应答者之间的肿瘤微环境。
研究人员采用了一种常用的策略,即从细胞水平入手,然后深入研究肿瘤微环境的空间结构。在细胞水平上,无应答者的癌细胞比例较高;相反,应答者的免疫细胞(T细胞、浆细胞、单核细胞和巨噬细胞)比例较高,与抗肿瘤应答一致。
为了分析肿瘤微环境的空间结构,作者对每个细胞周围最近的10个细胞进行划分,在每个组织样本中生成了细胞邻域(CN),然后比较了应答者和无应答者的每个CN比例。与预期相一致,应答者中丰度最高的CN与抗肿瘤活性相关,包括细胞毒性T细胞以及T细胞/与肿瘤互作的巨噬细胞邻域(图3)。
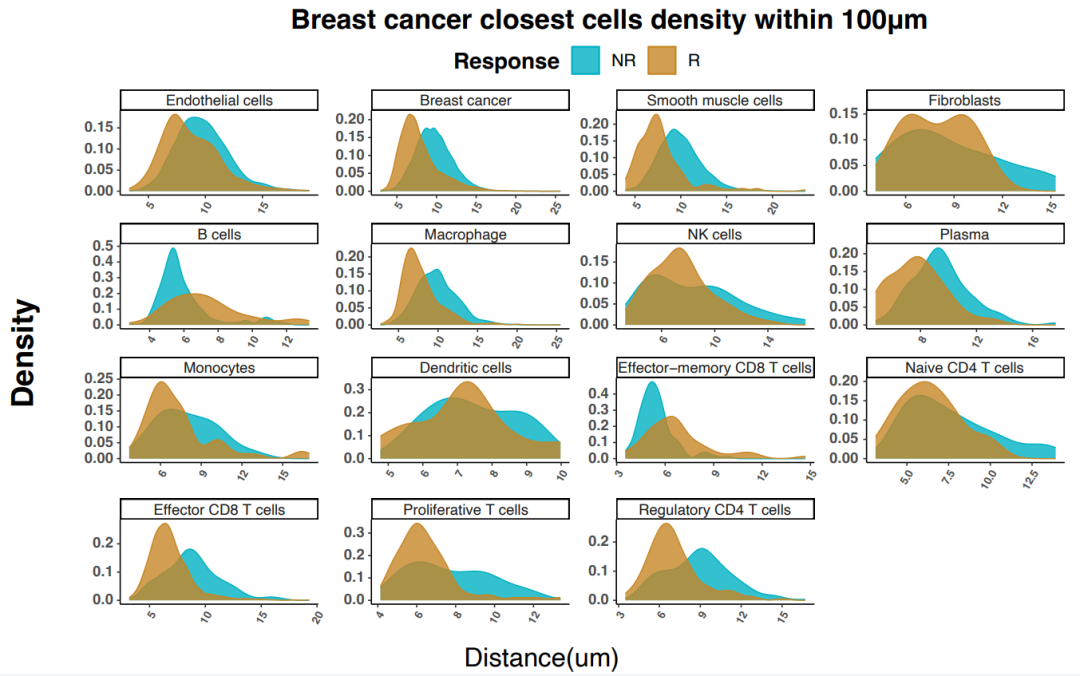
图3. 根据与最近乳腺癌细胞的距离划分的特定细胞类型密度。蓝色曲线代表无应答者,棕色曲线代表应答者。图片改编自Wang等人论文中的图4D。(CC BY 4.0).
重要的是,作者指出,细胞毒性T细胞和与肿瘤互作的巨噬细胞邻域(CN5)在应答者组中更为普遍,而且往往更靠近肿瘤。在进一步放大后,他们发现,相对罕见的Ki-67+增殖性T细胞亚型在应答者与无应答者肿瘤附近的分布不成比例。结合应答者特异性的增殖性T细胞、效应T细胞和巨噬细胞共招募,这些发现揭示了细胞和空间数据的统一如何帮助人们更好地了解不同乳腺癌亚型的治疗应答。
04 空间限定的配体/受体作为潜在的生物标志物
由于细胞间通讯的改变代表了应答者与无应答者产生不同应答的潜在机制,研究人员接下来研究了肿瘤富集ROI中的受体-配体对。
一些配对在应答者和无应答者中都能观察到,比如CD86/CTLA4(T细胞抑制性巨噬细胞和T细胞通讯)。然而,树突状细胞、T细胞和巨噬细胞上的T细胞刺激性CD274/CD80通讯只能在应答者中观察到。在一名TNBC-LN-Met应答者中,他们观察到CD8+ T细胞与其他免疫细胞之间也存在这种CD274/CD80相互作用,再次突出了乳腺癌亚型的异质性。其中最有趣的发现是,“对Xenium数据的空间细胞注释表明,浸润的CTLA4+ 效应T细胞和PD-L1+ 巨噬细胞与癌细胞直接通讯,且仅仅出现在应答者中”(图4)。
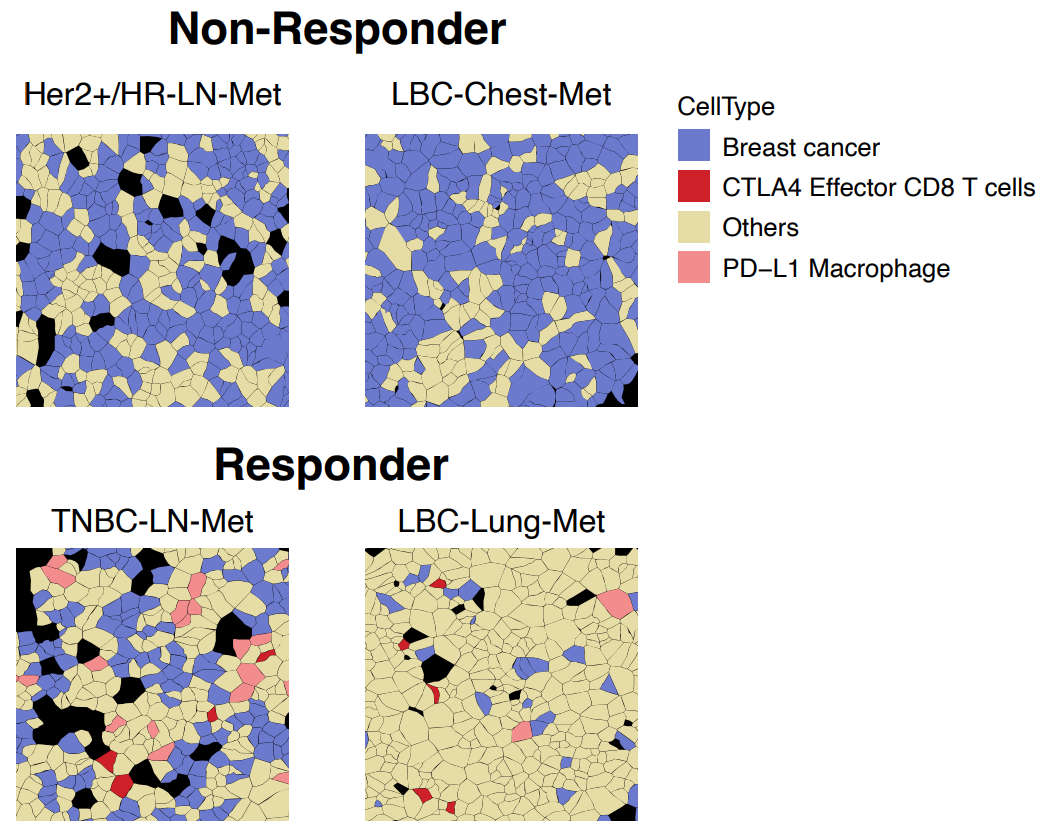
图4. 细胞共定位揭示了应答者特有的免疫细胞与癌细胞的相互作用。图片改编自Wang等人论文中的图5C。(CC BY 4.0).
最后,研究人员试图利用他们的成果来发现潜在的生物标志物。他们分析了已知的ICI生物标志物PD-L1 (CD274) RNA在肿瘤细胞中的表达情况,以及其他潜在生物标志物的RNA水平,包括PD-L2 (PDCD1LG2)、NKG7和CD80。所有这些RNA不仅在应答者中明显上调,而且比PD-L1表现出更大的统计学意义,这为利用单细胞空间技术进一步探索和验证潜在的生物标志物带来了有趣的可能性。
05 利用单细胞空间技术开创未来
非因生物的这些研究成果突出了在免疫肿瘤学研究中了解细胞和空间异质性的重要性。通过展示肿瘤微环境在细胞组成、共定位和通讯方面的复杂性(所有这些都需要单细胞和空间数据来解析),他们的预印本揭示了不同乳腺癌类型的分子和空间结构如何变化,这提高了发现新型生物标志物的机会,也为患者分层奠定了基础。
点击此处,即可帮助您了解高性能的Xenium原位分析技术以及最新的Xenium Prime 5K分析试剂,能够通过超高精度的单细胞空间成像,表征细胞和组织中高达5000个基因。
欢迎扫码联系我们询价或了解更多信息

参考文献:
1. Wang N, et al. Spatial single-cell transcriptomic analysis in breast cancer reveals potential biomarkers for PD1 blockade therapy. Research Square (preprint) (2024). doi: 10.21203/rs.3.rs-4376986/v2