
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Cell Stem Cell | 北京大学王凯团队建立iPSC衍生血管畸形新模型,助力AI驱动的药物筛选
【字体: 大 中 小 】 时间:2024年11月28日 来源:北京大学医学部
编辑推荐:
?? 2024 年 11 月 21 日,北京大学基础医学院血管稳态与重构全国重点实验室的王凯研究员和孔炜教授,与北京大学第三医院临床干细胞研究中心的王茜研究员以及北京大学国际癌症研究院的谢正伟研究员团队合作在 Cell Stem Cell 期刊上发表题为 Generation of iPSC-derived human venous endothelial cells for the modeling of vascular malformations and drug discovery 的研究论文, 开发了一种高效的静脉内皮细胞( iVEC )分化方案,进一步利用携带 TIE2- L914F 杂合突变的 iPSC 衍生的 iVEC 复现了静脉畸形的病理特征,利用 AI 辅助的药物预测结合 Drug-seq ,发现 FDA 批准原本用于治疗白血病的药物博舒替尼( Bosutinib ),能有效地改善血管畸形的表型,具有临床应用的潜力
静脉畸形(Venous malformations, VM)是由静脉内皮细胞(VECs)内的体细胞突变导致的最常见的血管畸形,发病率为万分之一到万分之二。静脉畸形的典型症状为血管结构异常、患病部位疼痛、肿胀和出血以及器官功能障碍。目前常用的治疗方法包括硬化治疗和手术切除等,虽能有效控制但也面临不能彻底治愈,费用昂贵以及较高的手术风险等问题。而针对VM的药物治疗方案仍有很大空白,目前尚未有FDA批准药物的一个主要原因是缺乏能复现疾病症状,成本可控且容易大规模复制的疾病模型。VM的致病性体细胞突变通常不可遗传且局部发病,所以涉及转基因动物育种的传统方法并不适用。此外,利用AAV病毒等手段在小鼠模型中递送突变体的方式,虽能呈现血管畸形的表型,但也存在着高成本,稳定性低和人鼠差异的缺点。因而,开发一种全新的血管畸形模型,对于血管畸形的病理机制研究和相关的药物开发有着重要意义。??
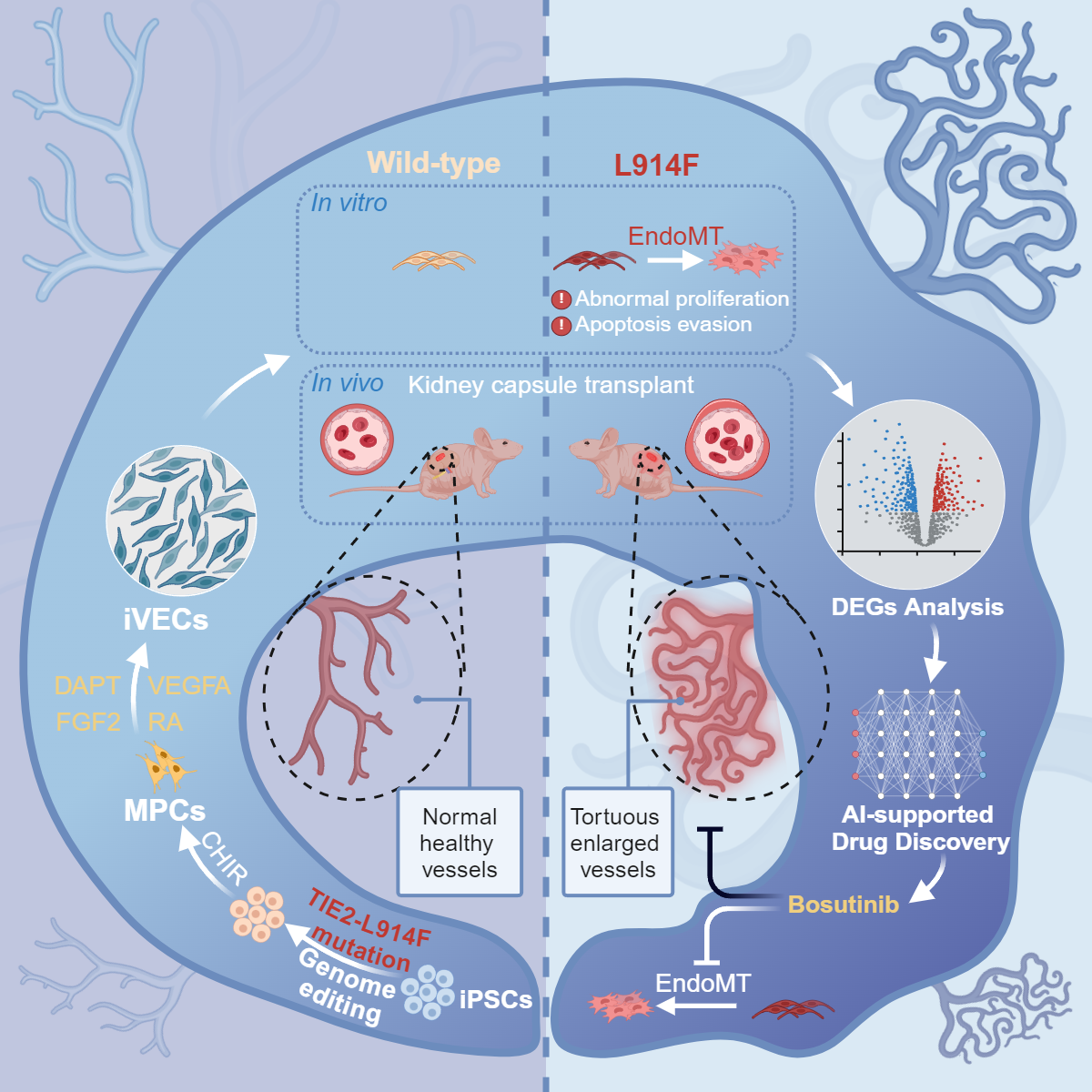
2024年11月21日,北京大学基础医学院血管稳态与重构全国重点实验室的王凯研究员和孔炜教授,与北京大学第三医院临床干细胞研究中心的王茜研究员以及北京大学国际癌症研究院的谢正伟研究员团队合作在Cell Stem Cell期刊上发表题为Generation of iPSC-derived human venous endothelial cells for the modeling of vascular malformations and drug discovery的研究论文,开发了一种高效的静脉内皮细胞(iVEC)分化方案,进一步利用携带TIE2-L914F杂合突变的iPSC衍生的iVEC 复现了静脉畸形的病理特征,利用AI辅助的药物预测结合Drug-seq,发现FDA批准原本用于治疗白血病的药物博舒替尼(Bosutinib),能有效地改善血管畸形的表型,具有临床应用的潜力。

该研究聚焦VMs最常见的致病突变TIE2 p.L914F(c.2740 C>T)。TIE2 (TEK)是受体酪氨酸激酶亚家族成员,主要表达于内皮细胞,在血管生成、重塑、成熟和完整性方面发挥重要作用。目前模拟血管畸形最广泛使用的细胞模型是 HUVECs 过表达的突变体。然而该类模型存在明显的失真问题。一方面是体外扩增的 HUVECs失去了部分静脉特性,另一方面是过表达产生的突变体剂量必然多于患者体内的杂合突变。为更好地模拟静脉的特性,研究团队开发了一个稳健的静脉内皮(iVECs)分化方案。该方案涉及调节视黄酸信号通路以调控细胞周期,从而促进向静脉内皮的特异性分化。针对突变拷贝数问题,团队利用基因编辑技术向iPSCs的TIE2基因中引入了L914F杂合点突变。
研究者在前人研究的基础上,通过对分化条件的不断调整,确定了以血管内皮生长因子VEGFA, 成纤维生长因子FGF2, NOTCH抑制剂DAPT和视黄酸(RA)为主要成分的稳定而高效的静脉内皮分化方案。进一步研究明确了其中的RA能够促使G1早期阻滞,从而促进向静脉谱系的分化。iVECs和iAECs的单细胞测序数据比对结果表明,MEF2C可能促进静脉内皮的分化。而该基因以往并没有被报道过在动静脉内皮的异向分化过程中起直接作用。基于此,研究人员过表达了MEF2C基因,发现静脉内皮细胞比例有所提高。对于iVECs进行功能验证证明其具有静脉特征,包括一氧化氮生成水平低、剪切应力响应弱、招募免疫细胞能力增强等。体内移植的iVECs同样能持续表达静脉标记物,且形成可灌注的管腔。
随后,研究者使用CRISPR-Cas9向iPSCs中引入了TIE2-L914F杂合突变。突变的iVECs复现了VM的病理表型,包括F-actin紊乱、增殖能力与抗凋亡能力增强、成管腔能力减弱。Bulk RNA-seq支持了突变型VM中相应通路和基因表达水平的异常。进一步将突变型iVECs移植到小鼠肾包囊下,形成了畸形血管并产生显著的功能异常。为了寻找到合适的VM治疗药物,团队使用了基于深度学习的DLEPS方法进行了药物预测。结合DRUG-Seq,团队推测博舒替尼是一种潜在的可用药物。向突变组给药后,其VM异常表型得到显著改善,证明了博舒替尼的治疗作用。进一步探究给药组的基因组表达及蛋白组表达情况发现,博舒替尼通过减弱突变组内皮间质转化水平而抑制细胞增殖,进而缓解了TIE2-L914F突变导致的异常表型。
综上,该研究发现视黄酸RA介导的细胞G1期阻滞并激活祖细胞向静脉内皮细胞转化所需的基因。作者在iPSCs中引入L914F杂合突变并分化为静脉内皮作为静脉畸形模型,利用深度学习和高通量DRUG-Seq方法鉴定出Bosutinib在体外和体内有效地挽救了疾病表型,为血管畸形领域潜在药物研发和临床治疗靶点提供了更多的可能。
该研究受到了国自然-面上项目、北自然-杰青项目、重点研发干细胞专项和四大慢病专项的资助,也受到了哈佛医学院/波士顿儿童医院Joyce Bischoff教授,北京大学未来技术学院赵扬研究员,北京大学医药卫生分析中心的刘皎副主任,北京大学第三医院成形外科的夏有辰主任和马建勋主任,南京市儿童医院烧伤整形外科的沈卫明主任,天新福(北京)医疗器材股份有限公司的孙冰冰和张伟博士,中国中医科学院张晶晶研究员以及首都医科大学附属北京安贞医院刘愚勇主任和姜文剑主任等的大力支持与帮助。
北京大学基础医学院生理学与病理生理学系博士研究生潘子航和姚启扬为本文的共同第一作者,北京大学基础医学院生理学与病理生理学系的王凯研究员和孔炜教授、北京大学第三医院临床干细胞研究中心的王茜研究员和北京大学国际癌症研究院的谢正伟研究员为本文的共同通讯作者。
值得一提的是,这项工作是王凯课题组近年来在“干细胞与血管类器官”方向上一系列工作的延续:(1)基于转录因子的无偏差筛选,发明了一种利用转录因子ETV2的瞬时激活定向诱导干细胞高效分化成血管内皮细胞的方案(Science Advances 2020)和利用转录因子NKX3.1的瞬时激活定向诱导干细胞分化成血管壁细胞的方案(Nature Communications 2024)。进一步利用动态生物反应器诱导干细胞自组装和分化形成动脉和静脉血管类器官,可以用于主动脉疾病、血管畸形和脑血管病的模拟 (Advanced Science 2024,Cell Stem Cell 2025)。(2)构筑基于三维仿生图形化多孔支架的血管化人工胰腺用于糖尿病的治疗 (ACS Appl. Mater. Interfaces 2024; Advanced Materials 2017; Biomaterials 2016, 2017)。
课题组网站:https://www.x-mol.com/groups/kai_wang_pku 诚邀志趣相投的本科生、研究生和博士后的加盟。
原文链接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(24)00377-1
(基础医学院)