
-

生物通官微
陪你抓住生命科技
跳动的脉搏
刘文教授团队揭示精氨酸甲基转移酶调控抗病毒先天免疫反应的功能...
【字体: 大 中 小 】 时间:2024年11月19日 来源:细胞应激生物学国家重点实验室(厦门大学)
编辑推荐:
2024 年 11 月 15 日,厦门大学药学院刘文教授团队在 PNAS 杂志在线发表了题为 “Targeting PRMT7-mediated mono-methylation of MAVS enhances antiviral innate immune responses and inhibits RNA virus replication” 的研究论文
先天免疫是人类机体抵御病原微生物感染的第一道防线。在哺乳动物中,天然免疫系统的激活主要通过模式识别受体(Pattern Recognition Receptors,PRRs)识别各种病原体(包括病毒、细菌以及真菌等)的保守的病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)。这种识别方式具有一定的特异性,例如,Toll样受体(Toll-like receptors,TLRs)可以识别细菌的脂多糖、脂蛋白、肽聚糖以及病毒的核酸等;视黄酸诱导基因I样受体(RIG-I-like receptors,RLRs)和环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)可以识别细胞质中的病毒核酸;NOD样受体(NOD-like receptors,NLRs)识别细菌成分如肽聚糖等;C型凝集素受体(C-type lectin receptors,CLRs)识别真菌、细菌和病毒等病原体表面的糖基化分子。当PRRs识别PAMPs后,激活宿主的先天免疫应答,触发信号级联反应,进一步激活宿主获得性免疫应答,最终清除病原体,维持机体稳态。
其中,RLR信号通路是先天免疫系统中识别并清除RNA病毒的关键信号通路。在机体中,多种调节机制的协同合作确保了RLR信号通路的正常功能,而当其调控紊乱时则会对机体的免疫系统产生严重的影响,并导致疾病的发生发展。RLR信号通路的失活将致使I型干扰素等抗病毒细胞因子的产生缺失,导致机体对病毒的识别和响应能力下降,继而引发严重的并发症甚至死亡。反之,若其过度活化,将导致持续性的炎症反应,组织损伤、引发自身免疫性疾病甚至危及生命。因此,深入探究RLR信号通路的调控机制对于充分了解、干预该信号通路并进而应用于临床治疗至关重要。然而,参与调控该信号通路的关键调控因子及其分子机制仍未完全明晰。
2024年11月15日,厦门大学药学院刘文教授团队在PNAS杂志在线发表了题为“Targeting PRMT7-mediated mono-methylation of MAVS enhances antiviral innate immune responses and inhibits RNA virus replication”的研究论文。该研究详细阐述了精氨酸甲基转移酶PRMT7通过靶向线粒体抗病毒信号蛋白MAVS抑制RLR信号通路介导的I型干扰素通路的功能和分子机制。

作者首先发现在RNA病毒感染的临床样本(如SARS-CoV-2和埃博拉病毒感染患者的血液样本,以及H1N1感染的支气管上皮细胞)中,PRMT7显著下调,暗示PRMT7与RNA病毒感染性疾病具有明显的临床相关性。随后,作者通过修饰组学数据分析和分子生物学实验发现PRMT7通过与RLR信号通路中的关键衔接蛋白MAVS相互作用并催化MAVS中第232位精氨酸(R)的单甲基化修饰(R232me1),充当I型干扰素信号通路的负调节因子。接着,作者发现RNA病毒感染会导致PRMT7表达下调并与MAVS解离,从而导致MAVS R232me1甲基化水平的降低,进而增强MAVS/RIG-I相互作用、MAVS聚集、I型干扰素信号激活和抗病毒免疫反应。此外,在动物水平上,作者发现将MAVS的R232替换为赖氨酸(K)的小鼠(MavsR232K-KI)的抗病毒免疫反应增强,对水疱性口炎病毒(Vesicular Stomatitis Virus,VSV)感染具有更强的抵抗力。
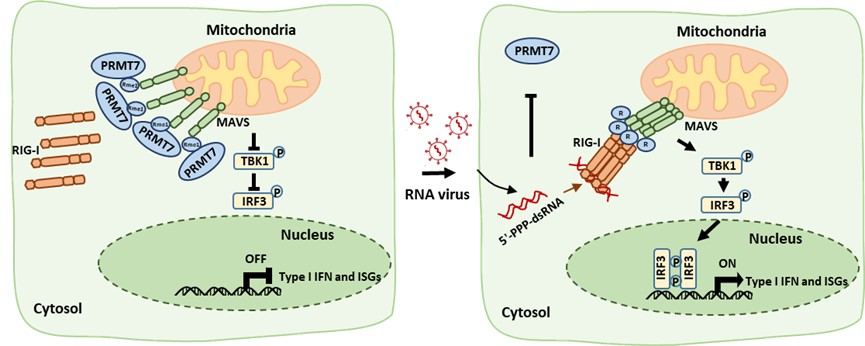
针对以上分子机制,作者设计并合成了一种旨在中断PRMT7与MAVS相互作用的短肽抑制剂PiPRMT7-MAVS。经验证,它能够抑制MAVS R232me1甲基化修饰,从而增强MAVS/RIG-I相互作用、促进MAVS聚集、激活I型干扰素信号通路,并增强抗病毒免疫反应以抑制RNA病毒复制。
这一研究结果揭示了PRMT7介导的精氨酸单甲基化修饰在调节MAVS介导的抗病毒免疫反应中发挥着关键作用,进一步深化了对抗病毒免疫调控机制的认识。同时,靶向精氨酸甲基化修饰有望为治疗RNA病毒感染提供一种有效的治疗途径。
厦门大学药学院刘文教授和深圳市第三人民医院(南方科技大学第二附属医院)杨扬教授为本文的共同通讯作者。
论文链接:www.pnas.org/doi/10.1073/pnas.2408117121
DOI: 10.1073/pnas.2408117121