
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:棕榈酰化修饰在细胞焦亡中的新作用
【字体: 大 中 小 】 时间:2024年11月12日 来源:中国科学院生物与化学交叉研究中心
编辑推荐:
中国科学院上海有机化学研究所生物与化学交叉研究中心许代超研究员在 Cell Press细胞出版社期刊 Trends in Cell Biology 发表了题为 “ Emerging roles of palmitoylation in pyroptosis ” 的综述
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心许代超研究员在Cell Press细胞出版社期刊Trends in Cell Biology 发表了题为“Emerging roles of palmitoylation in pyroptosis”的综述。该论文全面系统地总结了棕榈酰化修饰在细胞焦亡中扮演的各种角色,详细归纳了棕榈酰化修饰对细胞焦亡通路中关键蛋白的调控作用,并提出以棕榈酰化为切入点来治疗细胞焦亡相关的炎症性疾病的策略。

细胞焦亡是由各种感染性和无菌性损伤引发的一种独特的溶解性和炎症性程序性细胞死亡,主要由膜成孔蛋白gasdermin(GSDM)介导。尽管在过去的十年中,细胞焦亡的发生机制已经取得重大进展,但是GSDM激活、膜转运和孔形成的分子机制仍未阐释清楚。最近,多项研究揭示S-棕榈酰化(一种脂酰化修饰,将棕榈酸连接到靶蛋白半胱氨酸残基)在NLRP3炎症小体和GSDMD激活等多个层面上调控细胞焦亡,但相关分子机制仍有许多问题亟待进一步探究。因此系统性总结并归纳NLRP3和GSDMD棕榈酰化修饰在细胞焦亡中的重要功能对于进一步探究细胞焦亡发生的分子机制具有重要意义,并为潜在的治疗策略提供启示。
NLRP3棕榈酰化调节炎症小体和GSDMD介导的细胞焦亡
NLRP3炎症小体是一种大分子蛋白复合物,对维持机体平衡和抵御病原体感染至关重要,它由传感器(NLRP3)、适配蛋白(ASC)和效应器(Caspase-1)组成。NLRP3炎症小体可检测多种危险信号,并通过诱导细胞焦亡和分泌炎性细胞因子放大炎症反应。NLRP3的活性受多种翻译后修饰控制,近期的多项研究表明,棕榈酰化对NLRP3炎症小体的活性具有调控作用,并产生不同效应(图1)。
NLRP3炎症小体的激活受到多个半胱氨酸残基棕榈酰化的严格调控。在静息状态下,NLRP3的Cys130被棕榈酰转移酶DHHC1/3/5/7棕榈酰化,从而将其定位到跨高尔基网络(TGN)[1-3]。DHHC1在Cys958处的棕榈酰化作用进一步将NLRP3募集到TGN[3]。受到焦亡性刺激后,Cys130和Cys901的棕榈酰化会促进NLRP3转位至分散的TGN[1-4]。这将促进NLRP3运送到微管组织中心(MTOC),DHHC5在MTOC对Cys837, 838进行棕榈酰化,这增强了NLRP3的LRR结构域与NEK7之间的相互作用[5]。去棕榈酰基转移酶ABHD17A可以逆转这种棕榈酰化[5]。随后,DHHC17对Cys419进行棕榈酰化,进一步增强NLRP3的NACHT结构域与NEK7之间的相互作用,促进NLRP3的寡聚化[6]。因此,不同位点的棕榈酰化调节不同阶段NLRP3-NEK7的相互作用和炎症小体组装。此外,为终止炎症小体信号传导,DHHC12会对NLRP3的Cys844进行棕榈酰化,这会促进NLRP3被HSC70识别,通过自噬作用降解[7]。相反,去棕榈酰基转移酶PPT1对Cys8的去棕榈酰化增加了NLRP3的蛋白稳定性[8]。
因此,动态和位点特异性的棕榈酰化在不同阶段(定位、激活、与NEK7相互作用、终止)精确调节NLRP3炎症小体的组装,维持炎症小体信号传导的平衡。虽然不同的酶在不同的位点和阶段介导棕榈酰化,但这些修饰之间的协调仍有待全面阐明。
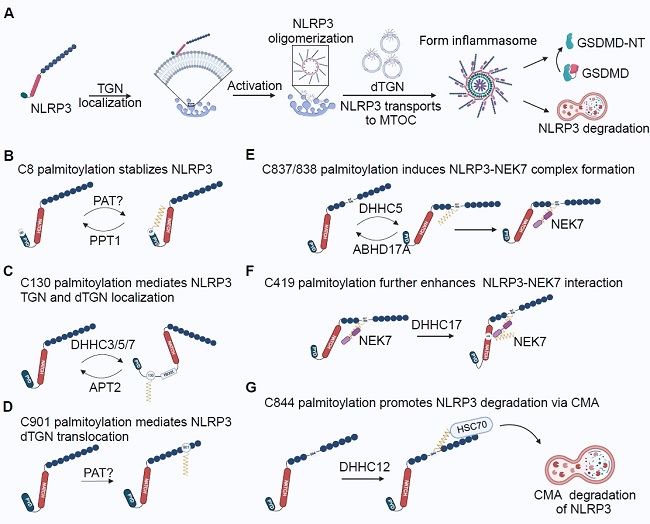
图1. 棕榈酰化多层次调控NLRP3炎症小体的激活
GSDMD的棕榈酰化促进其激活和细胞焦亡
尽管在过去十年中对GSDMD介导的细胞焦亡进行了深入研究,但人们对GSDMD孔隙形成的动态过程仍知之甚少。一个高度保守的半胱氨酸残基—Cys191被确定为GSDMD介导的细胞焦亡的关键位点。最近的研究发现,Cys191的棕榈酰化在细胞焦亡中起着重要作用[9-12]。包括DHHC5、7和9在内的几种棕榈酰基转移酶(PATs)介导这一过程,但具体的PATs因细胞类型而异。去棕榈酰基转移酶APT2可逆转GSDMD的棕榈酰化[10]。
在巨噬细胞中,GSDMD在受到脂多糖LPS刺激后发生棕榈酰化,这与NLRP3的组成型棕榈酰化不同。LPS会通过上调PATs自棕榈酰化(如DHHC7)和表达水平(如DHHC5, 9)来诱导GSDMD发生棕榈酰化。此外,各种炎症小体激活剂也会诱导GSDMD棕榈酰化,这表明GSDMD棕榈酰化可能是由应激反应激活。其中,活性氧ROS在诱导GSDMD棕榈酰化方面发挥了关键作用。ROS能够促进炎症小体激活剂诱导的GSDMD的棕榈酰化,也可增强LPS诱导的棕榈酰化。然而,ROS引发GSDMD棕榈酰化的确切机制以及ROS的来源仍不清楚。
GSDMD的棕榈酰化还可以多种方式促进其激活和剪切。棕榈酰化不仅可以促进Caspase-1对GSDMD的切割,还能通过引发构象改变克服GSDMD-C末端的自抑制作用,激活全长的GSDMD。剪切后的GSDMD-N末端(GSDMD-NT)的棕榈酰化还可增强其膜转运。因此,动态棕榈酰化可在不同阶段精确调节GSDMD的激活、孔形成和细胞焦亡,这与NLRP3的调节作用类似。这种修饰通过调节动力学对细胞焦亡的炎症反应进行精细调控(图2)。
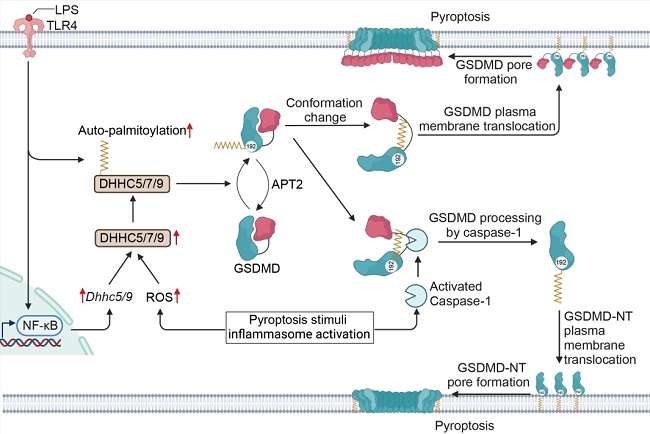
图2. GSDMD的棕榈酰化促进其激活和细胞焦亡
Gasdermin家族其他成员的棕榈酰化
除GSDMD外,棕榈酰化还能调节其他gasdermin家族成员。GSDMA、GSDMB、GSDMC和GSDME的N端都能被棕榈酰化。此外,GSDME的C端已被证明对化疗诱导的细胞焦亡非常重要。GSDME的C端被DHHC2、6、7、11和15棕榈酰化后,会促进GSDME的C端与其N端分离,从而促进N端形成孔隙并引发细胞焦亡。虽然GSDME-NT棕榈酰化的作用尚不清楚,但它可能同样会影响膜转运和膜结合。
细菌的GSDMs也受到棕榈酰化调节。其保守的N端半胱氨酸残基发生棕榈酰化后能够稳定自抑制状态。但这种棕榈酰化也能使细菌GSDMs在被激活后执行膜插入并诱导细胞死亡。因此,细菌似乎广泛利用棕榈酰化来协助GSDM的膜结合,从而削弱孔隙形成的能量障碍并诱导细菌裂解。由此可见,棕榈酰化对细胞焦亡调控具有物种保守性。
总结与展望
总之,棕榈酰化是NLRP3炎症小体和GSDMD激活的关键调控步骤,这一发现对我们了解细胞焦亡的启动和调控具有重要意义。NLRP3棕榈酰化发生在炎症小体激活的每个阶段,并且可促进或限制炎症小体的激活,这具体取决于发生的时间和空间。与NLRP3棕榈酰化的复杂性不同,GSDMD棕榈酰化只发生在一个保守的半胱氨酸残基上,而这个半胱氨酸残基对细胞焦亡至关重要。GSDMD的棕榈酰化作用显然是决定GSDMD-NT在细胞焦亡过程中膜转运的关键因素,而且这一过程在细菌中是保守的。尽管取得了这些进展,但我们对各种细胞焦亡性刺激与NLRP3和GSDMD棕榈酰化之间的关联机制的了解仍不甚清晰。此外,还需要更详细地研究NLRP3不同位点的棕榈酰化如何相互结合以及如何与GSDMD棕榈酰化结合,这可能会揭示NLRP3和GSDMD在先天性免疫中的重要功能的另一层复杂性。因此,进一步研究棕榈酰化在细胞焦亡中的机制和作用具有显著意义。
参考文献
[1] T. Yu, D. Hou, J. Zhao, X. Lu, W. K. Greentree, Q. Zhao, M. Yang, D. G. Conde, M. E. Linder, H. Lin, NLRP3 Cys126 palmitoylation by ZDHHC7 promotes inflammasome activation, Cell Rep 2024, 43, 114070.
[2] D. M. Williams, A. A. Peden, S-acylation of NLRP3 provides a nigericin sensitive gating mechanism that controls access to the Golgi, Elife 2024, 13.
[3] L. Nie, C. Fei, Y. Fan, F. Dang, Z. Zhao, T. Zhu, X. Wu, T. Dai, A. Balasubramanian, J. Pan, Y. Hu, H. R. Luo, W. Wei, J. Chen, Consecutive palmitoylation and phosphorylation orchestrates NLRP3 membrane trafficking and inflammasome activation, Mol Cell 2024, 84, 3336-3353.e3337.
[4] S. Leishman, N. M. Aljadeed, L. Qian, S. Cockcroft, J. Behmoaras, P. K. Anand, Fatty acid synthesis promotes inflammasome activation through NLRP3 palmitoylation, Cell Rep 2024, 43, 114516.
[5] S. Zheng, X. Que, S. Wang, Q. Zhou, X. Xing, L. Chen, C. Hou, J. Ma, P. An, Y. Peng, Y. Yao, Q. Song, J. Li, P. Zhang, H. Pei, ZDHHC5-mediated NLRP3 palmitoylation promotes NLRP3-NEK7 interaction and inflammasome activation, Mol Cell 2023, 83, 4570-4585.e4577.
[6] D. Hu, Y. Li, X. Wang, H. Zou, Z. Li, W. Chen, Y. Meng, Y. Wang, Q. Li, F. Liao, K. Wu, J. Wu, G. Li, W. Wang, Palmitoylation of NLRP3 Modulates Inflammasome Activation and Inflammatory Bowel Disease Development, J Immunol 2024, 213, 481-493.
[7] L. Wang, J. Cai, X. Zhao, L. Ma, P. Zeng, L. Zhou, Y. Liu, S. Yang, Z. Cai, S. Zhang, L. Zhou, J. Yang, T. Liu, S. Jin, J. Cui, Palmitoylation prevents sustained inflammation by limiting NLRP3 inflammasome activation through chaperone-mediated autophagy, Mol Cell 2023, 83, 281-297.e210.
[8] D. Lv, X. Cao, L. Zhong, Y. Dong, Z. Xu, Y. Rong, H. Xu, Z. Wang, H. Yang, R. Yin, M. Chen, C. Ke, Z. Hu, W. Deng, B. Tang, Targeting phenylpyruvate restrains excessive NLRP3 inflammasome activation and pathological inflammation in diabetic wound healing, Cell Rep Med 2023, 4, 101129.
[9] G. Du, L. B. Healy, L. David, C. Walker, T. J. El-Baba, C. A. Lutomski, B. Goh, B. Gu, X. Pi, P. Devant, P. Fontana, Y. Dong, X. Ma, R. Miao, A. Balasubramanian, R. Puthenveetil, A. Banerjee, H. R. Luo, J. C. Kagan, S. F. Oh, C. V. Robinson, J. Lieberman, H. Wu, ROS-dependent S-palmitoylation activates cleaved and intact gasdermin D, Nature 2024, 630, 437-446.
[10] N. Zhang, J. Zhang, Y. Yang, H. Shan, S. Hou, H. Fang, M. Ma, Z. Chen, L. Tan, D. Xu, A palmitoylation-depalmitoylation relay spatiotemporally controls GSDMD activation in pyroptosis, Nat Cell Biol 2024, 26, 757-769.
[11] A. Balasubramanian, A. Y. Hsu, L. Ghimire, M. Tahir, P. Devant, P. Fontana, G. Du, X. Liu, D. Fabin, H. Kambara, X. Xie, F. Liu, T. Hasegawa, R. Xu, H. Yu, M. Chen, S. Kolakowski, S. Trauger, M. R. Larsen, W. Wei, H. Wu, J. C. Kagan, J. Lieberman, H. R. Luo, The palmitoylation of gasdermin D directs its membrane translocation and pore formation during pyroptosis, Sci Immunol 2024, 9, eadn1452.
[12] Z. Liu, S. Li, C. Wang, K. J. Vidmar, S. Bracey, L. Li, B. Willard, M. Miyagi, T. Lan, B. C. Dickinson, A. Osme, T. T. Pizarro, T. S. Xiao, Palmitoylation at a conserved cysteine residue facilitates gasdermin D-mediated pyroptosis and cytokine release, Proc Natl Acad Sci U S A 2024, 121, e2400883121.
 生物通微信公众号
生物通微信公众号
知名企业招聘