
-

生物通官微
陪你抓住生命科技
跳动的脉搏
专家点评Nature | 胡政/贺雄雷/何真团队合作揭示早期肿瘤从多克隆至单克隆转变的演化新模式
【字体: 大 中 小 】 时间:2024年11月04日 来源:深圳先进技术研究院
编辑推荐:
中国科学院深圳先进技术研究院合成生物学研究所胡政、中山大学贺雄雷和何真团队在Nature在线发表论文,首次揭示了肿瘤从多克隆向单克隆转变的早期演化新模式,并解析了肿瘤多克隆起源的细胞间通讯与互作机制。这一发现不仅为肿瘤的早期发生机制提供了新的科学视角,同时也为癌症的精准早期筛查和干预提出了新的思路
理解肿瘤的早期发生机制,对实现肿瘤的早期预防和治疗至关重要。传统的Peter Nowell克隆演化理论认为,肿瘤是由一个发生致癌突变的单一细胞引起,经过不断的细胞扩增和筛选,最终形成恶性肿瘤。这一理论强调肿瘤具有“单克隆起源”,即肿瘤由一个细胞起源并扩增而来。然而,对于肿瘤在更早期阶段的癌前病变过程,我们的了解还非常有限。例如,在癌前病变中,是否存在多个独立突变的细胞群体共同推动肿瘤发展(即“多克隆起源”)?目前这个问题还没有明确答案。总体来说,对早期肿瘤起源和发生机制的认识不足,极大地限制了我们在肿瘤精准筛查和早期干预上的突破。
北京时间10月30日24时,中国科学院深圳先进技术研究院合成生物学研究所胡政、中山大学贺雄雷和何真团队在Nature在线发表题为“Polyclonal-to-monoclonal transition in colorectal precancerous evolution”的研究论文,首次揭示了肿瘤从多克隆向单克隆转变的早期演化新模式,并解析了肿瘤多克隆起源的细胞间通讯与互作机制。这一发现不仅为肿瘤的早期发生机制提供了新的科学视角,同时也为癌症的精准早期筛查和干预提出了新的思路。

图1. 文章上线截图
研究团队首次在哺乳动物中建立了基于碱基编辑器的细胞谱系示踪技术(称为SMALT),实现了小鼠体内单细胞分辨率的高精度谱系追踪。SMALT技术结合了胞苷脱氨酶(AID)、人工DNA条形码序列和Tet-On可诱导表达系统,通过AID介导的靶向突变和后续DNA测序,能够大规模、高精确地重建单细胞谱系树(图2a)。研究团队利用携带SMALT系统的转基因小鼠,构建了两种经典的小鼠肠癌模型:炎症诱导肠癌模型(AOM/DSS模型)和多发性息肉模型(ApcMin/+模型)。在谱系树分析中,团队发现大多数(66.7%)炎症诱导的肠癌和所有Apc肠息肉均表现出多克隆起源(图2b)。通过整合DNA条形码突变、全基因组测序和单细胞转录组数据,研究团队进一步发现单克隆肿瘤(图2c)比多克隆肿瘤具有更高的恶性程度,这表明单克隆肿瘤可能代表肿瘤进展的更“晚期”阶段。基于这些发现,团队提出了肿瘤发生的“多克隆向单克隆转变”新模型(图2d),为早期肿瘤演化提供了新的理论框架。
研究团队同时收集了107例人类散发性肠息肉及伴发结直肠癌的患者队列。基因组测序数据显示,大约30%的人类肠息肉是多克隆起源,且具有较低的突变负荷和拷贝数变异。病理特征也表明,相比单克隆息肉,多克隆息肉尺寸更小、恶性程度更低;相反,单克隆息肉表现出更多的基因组变异、较大尺寸和更高的恶性程度。这些发现在人体中验证了小鼠的谱系示踪结果,共同支持了多克隆向单克隆转变的早期肿瘤演化模式。
基于上述结果,研究团队提出了早期肿瘤发生过程中多克隆-单克隆转换的新模式(图2d),强调了这一过程中特定基因组和微环境变化以及细胞间相互作用的重要性。这些发现为理解肿瘤起源提供了全新的概念框架,并提出通过靶向细胞间通讯来实现早期干预的肿瘤预防新策略。因此,该研究开辟了一个新的研究领域,即探索早期肿瘤发生中的多克隆形成机制和细胞间相互作用,为肿瘤早筛、风险预测和早期靶向干预提供了全新的思路。
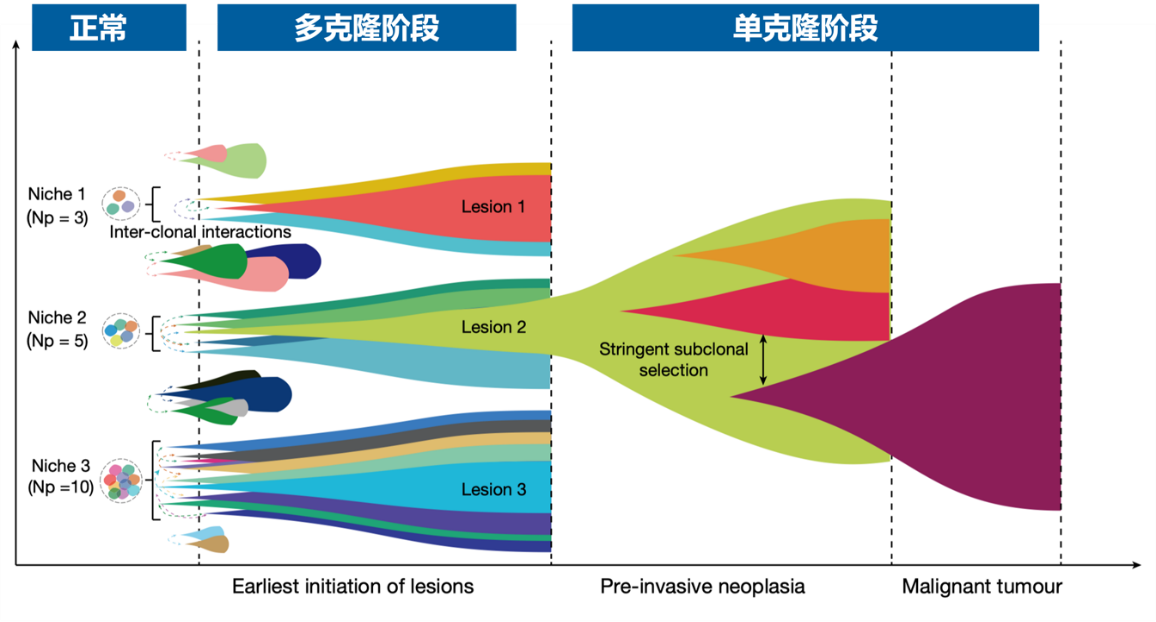
图2. 单细胞谱系示踪早期肿瘤从多克隆至单克隆转变的演化新模式。
中国科学院深圳先进技术研究院合成生物学研究所胡政研究员、中山大学生命科学学院贺雄雷教授和中山大学第六附属医院何真教授为本文共同通讯作者。中国科学院深圳先进技术研究院助理研究员逯召莲博士、莫珊兰博士;中国科学院深圳先进技术研究院-澳门大学联合培养博士研究生解铎;中山大学博士研究生翟相威、博士后邓善俊博士为论文的共同第一作者。该项研究成果获得国家重点研发计划、国家自然科学基金、中国科学院、广东省自然科学基金和深圳合成生物学创新研究院等项目的资助。
原文链接:https://www.nature.com/articles/s41586-024-08133-1
论文示意图:

图注:孔雀羽毛颜色从多彩逐渐向单一转变,表达了肿瘤细胞从多克隆状态逐渐向单克隆状态演化的过程。
专家点评
詹启敏(中国工程院院士,北京大学博雅讲席教授,分子肿瘤学家)
胡政、贺雄雷和何真团队在Nature上发表的这项研究,标志着对肿瘤早期演化过程的认知跃上新台阶。该研究首次提出了从多克隆到单克隆转变的早期肿瘤演化模式,并揭示了这一过程中的细胞间通讯与微环境变化的重要作用机制。这一发现不仅突破了经典的单克隆起源理论,还拓展了我们对肿瘤异质性起源及其演化的理解,为精准医学的早期干预策略开辟了新的方向。
肿瘤的多克隆起源现象在该研究中得到了首次系统性证实。通过高分辨率细胞谱系示踪技术和单细胞转录组测序,研究团队在小鼠模型和人类癌前病变组织中观察到,早期肿瘤病变往往具有多个独立的细胞克隆来源,这些克隆在肿瘤发生的早期阶段通过细胞间的通讯和合作共同推动病变进展。随着肿瘤的发展,这些多克隆逐渐被一个优势克隆所替代,转变为单克隆肿瘤,这种动态转变过程在基因组水平和微环境相互作用中表现得尤为显著。这一机制的解析为肿瘤的分期、预测与个体化治疗策略提供了新的理论基础。
从精准医学的角度来看,这一发现对肿瘤早期诊断和干预具有重要意义。传统的早期肿瘤筛查主要依赖于检测单一驱动突变的标志物,然而这种方法在多克隆起源的肿瘤中可能具有局限性。本研究所揭示的多克隆起源和细胞间通讯机制,提示我们需要关注多种基因突变和细胞互作网络,从而识别出具有进展潜力的多克隆病变。这为开发靶向多克隆阶段的干预措施提供了重要依据,例如通过抑制细胞间的通讯通路以阻止肿瘤演化的策略。
总而言之,此项研究为肿瘤早筛、预防和个体化干预提供了全新思路。通过深入理解肿瘤早期演化的基因组学特征,我们有望实现更为精准的早期癌前病变检测和风险预测,推动肿瘤精准医学向前迈进,为肿瘤防治提供科学依据。
吴仲义(中山大学讲座教授,台湾“中央研究院”院士,前芝加哥大学进化生态系主任,前中科院北京基因组所所长)
20世纪70年代Peter Nowell首次系统性地提出了肿瘤的克隆演化学说(clonal evolution theory),认为肿瘤是单一起源、但发展出高度遗传多样性的细胞群体,是在达尔文自然选择驱动作用下的克隆演化过程。这一理论的提出正值分子生物学和遗传学快速发展的时期,诸如DNA测序等技术的迅速崛起,极大推动了人们对于肿瘤生物学、克隆异质性和演化机制的深入认识。
然而,关于肿瘤演化早期的单克隆起源或者多克隆起源假说一直以来备受争论。一方面,基因组测序似乎支持 Nowell 的单克隆起源观点。另一方面,测序数据仅能说明,绝大多数癌细胞属于同一克隆。在细胞竞争之下,其他克隆在肿瘤开始增长之后很难检测到。同时 Field cancerization 的理论也提出相对的看法,即一个可以产生细胞克隆的微环境应该可以产生不止一个细胞克隆。 2022 年,中山大学陈冰洁等Natl Sci Rev 2022 也支持这个多克隆起源的观点。
近年来,谱系示踪技术等新技术的开发与应用使得肿瘤演化研究进入了全新的阶段。在这篇论文中,胡政、贺雄雷和何真联合团队精巧地利用了谱系追踪的技术,从源头开始观察肿瘤克隆的多起源。 他们发现小鼠和人类早期肠癌中普遍存在多克隆起源模式。虽然过去的研究也偶尔发现多克隆起源,胡政等的结论是多克隆起源非常普遍。基本上大幅度扩展了Peter Nowell克隆演化理论的单一起源学说。
胡政等另一个结论是多克隆肿瘤内细胞间似乎以相互合作为主而不是相互竞争。 这个论点可以从很多角度思考。合作在进化过程一般仅限于同一基因型。他们的观察是否符合这个常规还不清楚。其背后的驱动机制还需进一步研究。总之,该新理论范式的提出将不仅推动体细胞演化学科的进步,更期待该研究成果为肿瘤的早期诊断和个性化治疗提供新的指引。
白凡(北京大学教授,科学探索奖获得者)
传统的肿瘤克隆演化理论认为,肿瘤由单一突变细胞引发,通过连续的克隆扩增和选择最终形成。中国科学院深圳先进技术研究院胡政、中山大学贺雄雷和何真团队的Nature论文,该研究首次揭示了癌前病变阶段存在多克隆起源的现象,并提出了早期肿瘤从多克隆向单克隆转变的新模式,这一发现为理解肿瘤早期发生的多克隆到单克隆转变过程提供了重要的科学突破,对深入理解肿瘤的早期动态演化具有重要意义。
研究团队综合运用小鼠模型中的高分辨率细胞谱系示踪、单细胞转录组测序,以及人群样本的基因组测序,从多维度对早期多克隆病变中细胞的通讯和相互作用机制进行了深入剖析。研究发现早期的多克隆病变在向单克隆进展过程中,细胞间的通讯逐渐减少,这种细胞间的相互作用可能是多克隆形成的重要驱动力。该发现不仅为肿瘤起源提供了全新的概念框架,还指出了微环境和基因组改变对肿瘤演化的关键作用。
该研究的科学意义在于其为早期肿瘤筛查和靶向性预防提供了新的策略。通过靶向早期癌前病变中的细胞通讯网络,有望在肿瘤尚未进入单克隆阶段时进行有效干预,从而阻止肿瘤的进一步恶性演化。这项研究不仅推动了基础肿瘤学的前沿发展,也为精准医学和肿瘤预防提供了实践指导,将对未来的肿瘤早筛技术和风险预测可能产生重要的影响。同时,该研究综合运用了多种前沿技术手段,包括单细胞谱系示踪及动物模型、人群队列研究、单细胞转录组、肠道单隐窝测序、类器官、定量建模等等,代表了肿瘤学研究多学科交叉的新范式。

胡政团队