
-

生物通官微
陪你抓住生命科技
跳动的脉搏
化学学院王初课题组发现衣康酸抑制细菌生长新机制
【字体: 大 中 小 】 时间:2024年11月07日 来源:北京大学新闻网
编辑推荐:
研究团队发展和应用化学蛋白质组学技术对三种耐药菌的蛋白质组中潜在的半胱氨酸衣康酸化S-itaconation修饰靶点进行了挖掘,并揭示了衣康酸通过抑制鼠疫伤寒沙门氏菌的嘌呤从头合成途径来发挥其抑菌功能的分子机制。
近日,北京大学化学与分子工程学院、北大-清华生命科学联合中心王初课题组在Cell Reports上发表了题目为“In situ chemoproteomic profiling reveals itaconate inhibits de novo purine biosynthesis in pathogens”的研究论文。在这项工作中,作者们发展和应用化学蛋白质组学技术对三种耐药菌的蛋白质组中潜在的半胱氨酸衣康酸化S-itaconation修饰靶点进行了挖掘,并揭示了衣康酸通过抑制鼠疫伤寒沙门氏菌的嘌呤从头合成途径来发挥其抑菌功能的分子机制。
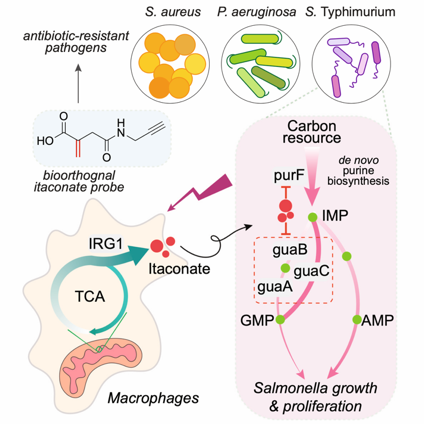
图1. 衣康酸抑制鼠疫沙门氏菌模式图
衣康酸能够共价地修饰在蛋白质的半胱氨酸残基上,形成 S-itaconation。越来越多的研究表明,这种新型翻译后修饰对于调控宿主的免疫具有重要的意义。对于病原菌而言,衣康酸既能帮助一些病原菌(比如,铜绿假单胞杆菌和肺炎克雷伯菌)更好地适应宿主的免疫,从而引起慢性感染;又能够抑制鼠疫沙门氏菌的生长。但是,具体的分子机制并不清楚。
为了研究衣康酸能够修饰在哪些病原菌的蛋白上,该工作借助之前开发的衣康酸探针C3A(Zhang et al., Chemical Science, 2022),实现了活菌水平的标记,并对质谱样品制备的方法进行优化,从而鉴定到了更多的衣康酸修饰位点。作者将该方法应用到了金黄色葡萄球菌、铜绿假单胞杆菌和鼠疫沙门氏菌等三种病原菌中,发现了大量全新的衣康酸修饰蛋白和修饰位点。针对鼠疫沙门氏菌的数据进行后续分析,作者发现衣康酸主要靶向细菌嘌呤从头合成途径中purF和guaABC等一些关键代谢酶的活性半胱氨酸。作者在纯蛋白水平上验证了衣康酸能够修饰purF和guaABC蛋白,并且抑制它们的体外酶活。靶向代谢组学进一步证明衣康酸能够下调该代谢通路产物AMP和GMP的含量。此外,细菌生长实验也表明,同时回补AMP和GMP能够解除衣康酸对鼠疫沙门氏菌生长的抑制效果。最后,作者们通过基因敲除回补,在细胞内和体外,同时证明了purF和guaB蛋白的S-itaconation位点对细菌生长的重要性。总之,该研究揭示了衣康酸是如何在更生理的环境中去发挥其抑菌功能的分子机制,这对于未来开发新的抗菌策略具有借鉴意义。
该文的通讯作者是王初,王初课题组2018级生命联合联合中心博士生研究生刘子华为第一作者,王初课题组的刘东阳同学为该课题作出了重要贡献。该工作得到了科技部国家重点研发计划(2022YFA1304700)和国家自然科学基金委重大研究计划(21925701, 92153301和 22321005)等项目的经费支持。