
-

生物通官微
陪你抓住生命科技
跳动的脉搏
生命科学学院邓宏魁课题组利用化学重编程技术诱导人体细胞去分化并制备可大规模扩增的人胚胎肢芽样细胞
【字体: 大 中 小 】 时间:2024年11月06日 来源:北京大学新闻网
编辑推荐:
该研究进一步证明了化学重编程技术可诱导人体细胞去分化(Chemically induced dedifferentiation),并制备可大规模扩增的胚胎肢芽样前体细胞。这一创新成果利用化学小分子精准调控细胞命运的特点,模拟低等动物的再生规律,为制备具有再生潜能和大规模扩增能力的人前体细胞开辟了新途径。
2024年10月22日,北京大学生命科学学院邓宏魁教授和关景洋副研究员课题组合作在Cell Stem Cell杂志在线发表题为“Generation of Human Expandable Limb-Bud-like Progenitors via Chemically Induced Dedifferentiation”的研究论文。该研究进一步证明了化学重编程技术可诱导人体细胞去分化(Chemically induced dedifferentiation),并制备可大规模扩增的胚胎肢芽样前体细胞。这一创新成果利用化学小分子精准调控细胞命运的特点,模拟低等动物的再生规律,为制备具有再生潜能和大规模扩增能力的人前体细胞开辟了新途径。

论文截图
邓宏魁课题组多年来一直致力于化学重编程调控细胞命运的研究。2013年,他们在国际上首次报道仅使用化学小分子逆转细胞发育时钟,将小鼠体细胞重编程为多能干细胞。这一原创性成果开辟了一条全新的体细胞重编程的路径(Science,2013;Cell,2015; Cell Stem Cell,2018 )。2022年,该团队又首次实现了利用化学小分子诱导人体细胞成为多能干细胞的技术体系,为人多能干细胞的制备提供了全新的途径,是干细胞领域底层技术的重要突破(Nature,2022 )。在此基础上,他们于2023年建立了更加快速、高效、满足临床应用需求的人体细胞化学重编程体系(Cell Stem Cell,2023 )。以糖尿病治疗为切入点,邓宏魁课题组证明了化学重编程诱导的人多能干细胞可以高效分化为胰岛细胞,并显著改善糖尿病猴的血糖控制 (Nature Medicine,2022;Nature Metabolism,2023 )。更令人振奋的是,该团队近期首次报道了利用化学重编程诱导多能干细胞制备的胰岛细胞移植,患者初步实现了1型糖尿病的临床功能性治愈 ( Cell,2024 )。这一系列的研究成果,证明了化学重编程技术在再生医学领域治疗重大疾病方面的巨大潜力和重要应用价值。目前,该团队还将化学重编程诱导的人多能干细胞分化为肝脏细胞、iTNK细胞等功能细胞,展现了人化学重编程的广泛应用前景(Cell Proliferation,2024; Cell Reports Methods,2024)。
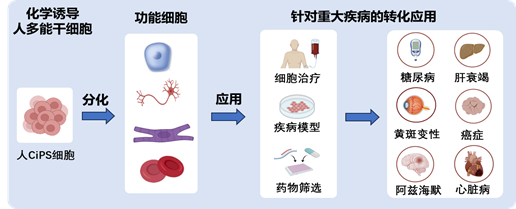
化学重编程诱导人多能干细胞的广阔应用前景
邓宏魁课题组研究发现,化学重编程技术与传统重编程技术存在本质的区别。传统的转基因重编程技术依赖于细胞内源的转录因子过表达,直接驱动细胞性质转变,难以实现细胞命运的精准调控。而化学重编程技术则利用化学小分子模拟外界信号刺激,类似自然发育中的细胞命运调控原理,以更加灵活可控的方式,促进细胞命运分阶段有序的调控。2015年的研究中,该团队发现化学重编程诱导小鼠多能干细胞过程中会经历独特的中间阶段 (Cell,2015 )。他们通过单细胞组学技术构建了小鼠化学重编程体系的完整分子路径(Cell Stem Cell,2018),揭示了化学重编程体系完全不同于转录因子介导的重编程的独特原理和路径。
该团队在2022年的研究中发现,人化学重编程的早期阶段会产生一种独特的高可塑性的中间态细胞,其染色质可及性增强,早期胚胎发育基因激活等特点。有趣的是,通过和低等动物再生去分化过程中的细胞性质比较,他们发现该阶段激活了与蝾螈断肢再生早期类似的基因表达特征(Nature,2022 )。该团队通过表观组学的系统解析,发现类再生可塑性状态的建立过程与生物体发育成熟过程中再生能力丧失的逆向过程极为相似(Cell Reports,2023)。这一系列的发现提示通过化学重编程技术精准调控细胞的命运,有望实现人体细胞逆向发育,将其诱导回前体细胞状态,从而重启人体细胞的再生潜能。
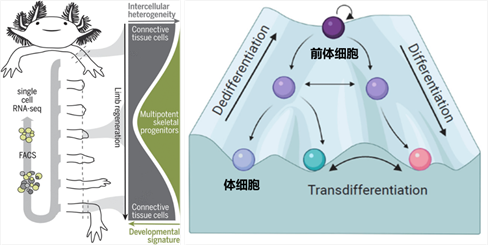
左图:蝾螈断肢再生过程中体细胞去分化产生前体细胞(Gerber et al ., Science, 2018);右图:Waddington model展示细胞分化与去分化过程(Granados et al., Int. J. Mol. Sci. 2020)
在自然界中,部分低等动物如蝾螈等,展现出了惊人的再生能力,其四肢、心脏、大脑等重要组织器官在损伤后可实现完美再生修复。这一神奇的能力主要归功于其体细胞具有的重要潜能——去分化(dedifferentiation),即分化的体细胞可以在损伤等信号刺激下,重新逆转发育为可快速增殖的类胚胎期的前体细胞状态,从而重新分化为功能细胞,修复损伤的组织器官。然而,哺乳动物,尤其是人类,由于其体细胞的命运更加稳固,可塑性下降,导致其再生能力非常有限。组织器官损伤后,人体细胞难以有效启动去分化程序,从而大大限制了受损组织或器官的再生。因此,如何模拟低等动物,有效诱导人体细胞的去分化以重新获得前体细胞,是干细胞与再生医学研究的重要科学问题之一。
在本研究中,邓宏魁课题组证实了在化学重编程早期阶段,化学小分子可诱导体细胞去分化为类人胚胎肢芽前体细胞(human Chemically induced Limb Bud-like Progenitors,简称人CiLBP细胞),并在此基础上建立了人CiLBP细胞长期稳定扩增的条件。通过单细胞转录组分析,研究团队发现人CiLBP细胞的转录组与人胚胎肢芽细胞相似。去分化相关基因LIN28A、SALL4等在人CiLBP细胞中高表达,同时体细胞相关基因表达降低,表明体细胞相关特征被擦除并启动再生相关基因网络。人CiLBP细胞高表达MSX1HOXA9和MEIS2等肢芽发育相关基因,与人类胚胎发育30天左右的肢芽细胞群状态非常类似。
肢芽细胞作为软骨细胞和骨细胞的祖细胞,最终能发育成四肢。相较于未经过化学重编程处理的亲代体细胞,人CiLBP细胞的成软骨和成骨能力显著提升。在成软骨条件诱导下,可高表达软骨相关基因,分泌相关蛋白,并可以形成软骨结节。体内移植实验表明,人CiLBP细胞能在体内自发分化产生软骨和骨样细胞,并在兔股骨髁缺损模型中促进骨损伤修复。重要的是,起始的人脂肪间质细胞或者人皮肤成纤维细胞扩增能力有限,而诱导获得的人CiLBP细胞可以在长达32次传代后,仍保留肢芽前体细胞特性,并保持良好的分化能力。这些特性证明,通过化学重编程诱导体细胞去分化获得的前体样细胞,不仅增强了分化能力,还具备大规模扩增的潜能,为其后续应用于骨和软骨相关疾病的治疗提供了新的细胞来源,具有重要的临床应用价值。
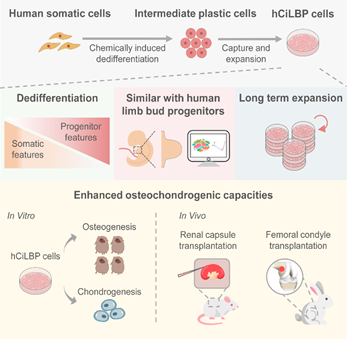
图4. 化学重编程技术诱导体细胞去分化为可大量稳定扩增的肢芽前体细胞
综上所述,邓宏魁课题组在本研究中利用化学重编程技术精准调控细胞命运,模拟低等动物组织再生中的去分化过程,实现了人体细胞向前体细胞的逆转,这一成果具有重要意义。(1)该研究进一步证明了化学重编程技术不同于传统转基因重编程技术,可通过分阶段有序的调控细胞性质,实现细胞命运的可控逆转,为实现人体细胞的去分化提供了全新的途径;(2)该研究为体外制备可大规模扩增的人前体细胞提供了新的方法,通过诱导去分化获得的人前体细胞具备了更强的分化能力及增殖能力,从而为受损组织和器官的细胞替代治疗提供了更理想的细胞来源;(3)利用化学重编程精准诱导人体细胞去分化的独特优势,有望直接激发体内组织和器官的再生潜能,模拟低等动物在组织和器官完美再生修复方面的神奇能力,为再生医学的发展提供新的可能性。
邓宏魁、关景洋是这一研究成果的共同通讯作者。北京北启生物医药有限公司朱家亮博士,北京大学钟新星、何焕景、曹靖宵为该研究成果的共同第一作者。北京大学李程教授和吕钰麟博士为本研究的生物信息分析提供了重要指导。本工作获得了国家自然科学基金、北京市自然科学基金等支持。