
-

生物通官微
陪你抓住生命科技
跳动的脉搏
JACS | 设计自组装多肽诱导蛋白聚集发展新颖肿瘤抑制剂
【字体: 大 中 小 】 时间:2024年10月26日 来源:中国科学院生物与化学交叉研究中心
编辑推荐:
近期, 国家纳米科学中心的王浩研究员与中国科学院上海有机化学研究所生物与化学交叉研究中心的刘聪研究员 合作,在《美国化学会志》( Journal of the American Chemical Society)上发表了一篇题为 “Homologous Peptide Foldamer Promotes FUS Aggregation and Triggers Cancer Cell Death” 的研究文章, 报道了运用多肽自组装分子相互作用原理开发 FUS靶向肽的新方法
Fused in Sarcoma (FUS) 是一种具有多种重要生理功能的RNA结合蛋白。FUS基因最初在人体脂肪肉瘤中被鉴定为一种融合癌基因,且其在某些类型的癌症(如低级别纤维粘液样肉瘤和粘液样脂肪肉瘤)细胞中表现出异常表达。此外,FUS的异常病理性相变聚集与渐冻人症(肌萎缩侧索硬化症,ALS)密切相关。因此,FUS作为相关疾病的重要潜在靶点长期以来备受关注。然而,由于FUS蛋白中存在大量无序结构区,精准设计FUS靶向分子成为极具挑战性的问题。
近期,国家纳米科学中心的王浩研究员与中国科学院上海有机化学研究所生物与化学交叉研究中心的刘聪研究员合作,在《美国化学会志》(Journal of the American Chemical Society)上发表了一篇题为“Homologous Peptide Foldamer Promotes FUS Aggregation and Triggers Cancer Cell Death”的研究文章,报道了运用多肽自组装分子相互作用原理开发FUS靶向肽的新方法。研究团队采用FUS蛋白的同源多肽序列作为模板进行靶向肽的设计,成功获得了能够特异性靶向FUS并且具有高度自组装能力的β4多肽。该多肽能够在细胞中通过诱导FUS的相变聚集从而使其功能失活来杀伤肿瘤细胞。这一工作为靶向FUS的抗肿瘤药物开发提供了全新的思路,同时也为新型自组装蛋白靶向肽的设计和研发开辟了新的途径。

在本研究中,研究人员首先基于FUS蛋白中RNA结合域的三维结构设计了四段β-折叠多肽片段,并通过ThT染料、透射电子显微镜(TEM)以及分子对接实验,发现其中的β3和β4片段在溶液中具有高度的自组装能力(图1)。接下来,研究人员通过共免疫沉淀(Co-IP)、计算机模拟以及表面等离子体共振(SPRi)实验,验证了β4片段能够与FUS蛋白的同源区域进行特异性结合。为了进一步将具有活性的β4多肽有效递送到细胞核中识别并调控FUS,研究人员在β4多肽的C末端融合了一段核定位序列(YGRKKRRQRRR,TAT)。通过计算机模拟等实验,研究结果表明TAT序列的整合并不会改变β4多肽的构象或其与FUS蛋白的结合模式。此外,β4-TAT多肽依然保持了较强的自组装能力。最后,研究人员证明了β4-TAT多肽能够进入细胞核,与FUS蛋白结合,并且由于其自组装特性,能够诱导FUS蛋白的异常聚集,最终导致肿瘤细胞的死亡(图2)。这一发现展示了利用自组装多肽设计FUS蛋白靶向药物的潜力。
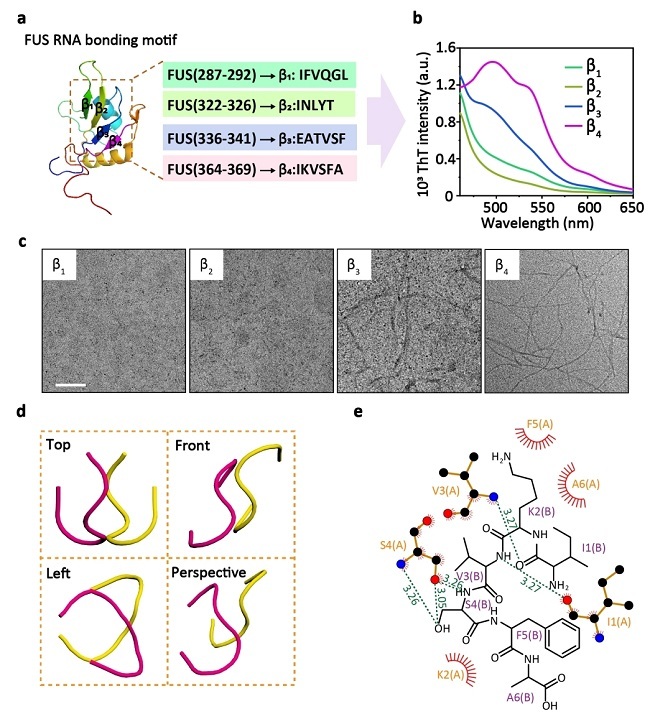
图 1 四条β-sheet多肽的选取及其自组装性质。(a) FUS RRM结构域中提取的四段多肽序列(β1、β2、β3、β4)。(b) 通过ThT荧光强度分析四段多肽水溶液的自组装性质。(c) β1~β4水溶液的TEM图像,比例尺 = 200 nm。(d) 两个β4多肽分子的分子对接图。(e) 分子结合机制分析,包含氢键和疏水相互作用。
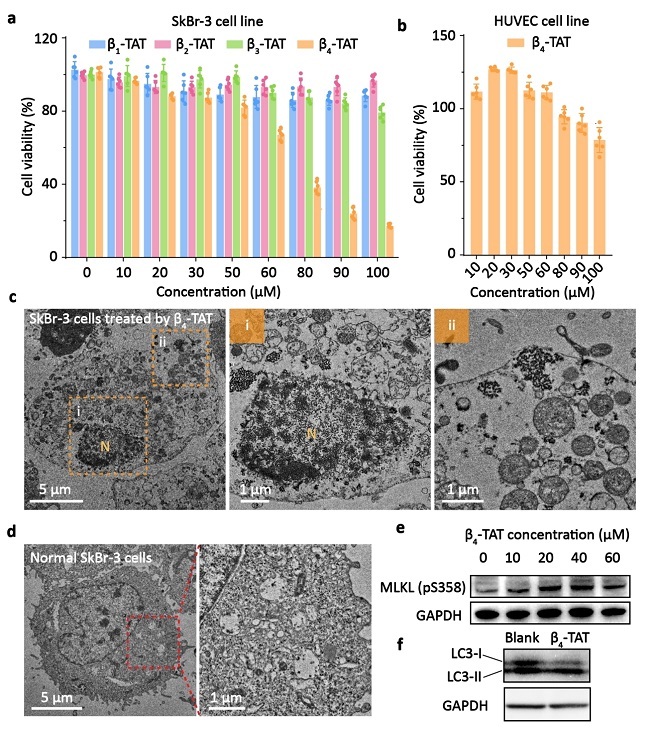
图2. β4-TAT对FUS高表达细胞系的选择性细胞毒性。(a) SkBr-3细胞在不同浓度下与β1-TAT、β2-TAT、β3-TAT和β4-TAT共孵育24小时后的细胞活力。(b) HUVEC细胞在不同浓度下与β4-TAT共孵育24小时后的细胞活力。(c) 用100 μM的β4-TAT多肽处理SkBr-3细胞4小时后的生物透射电镜(Bio-TEM)图像。(d) 正常SkBr-3细胞的生物透射电镜(Bio-TEM)图像。(e) SkBr-3细胞在与不同浓度的β4-TAT共孵育4小时前后的MLKL(pS358)蛋白表达水平的Western Blot分析。(f) SkBr-3细胞在与β4-TAT(60 μM)共孵育4小时前后的LC3蛋白表达水平的Western Blot分析。
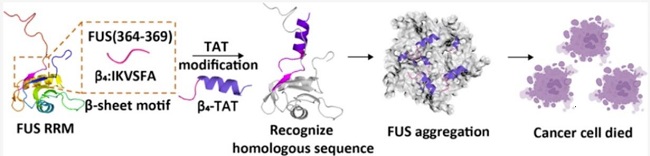
图3:β4多肽的设计流程及与诱导肿瘤细胞死亡的分子机制。
综上所述,本研究利用多肽自组装的特性,通过设计能够靶向识别FUS蛋白的活性β4多肽,诱导FUS在细胞中聚集,从而抑制肿瘤细胞的生长(图3)。这为靶向FUS的肿瘤药物研发提供了全新的思路。该研究的第一作者为国家纳米科学中心的王曼迪博士。王浩研究员与刘聪研究员为该论文的共同通讯作者。该工作得到了国家自然科学基金委、中国科学院及上海市科委的支持。
原文连接:https://pubs.acs.org/doi/10.1021/jacs.4c03420
 生物通微信公众号
生物通微信公众号
知名企业招聘