
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Environment International|徐丹课题组揭示地塞米松作为环境污染物的新角色及其对后代神经行为的长期影响
【字体: 大 中 小 】 时间:2024年10月24日 来源:武汉大学药学院
编辑推荐:
近日,武汉大学药学院徐丹教授课题组在 Environment International 杂志上发表了题为 Dexamethasone as an emerging environmental pollutant: Disruption of cholesterol-dependent synaptogenesis in the hippocampus and subsequent neurobehavioral impacts in offspring 的研究成果(全文链接: https://www.sciencedirect.com/science/article/pii/S0160412024006500 ),为我们揭示了这一联系
在现代医学中,地塞米松(Dexamethasone, DEX)以其强大的抗炎和免疫抑制特性,被广泛应用于人类和动物的医疗中。然而,随着DEX的广泛使用,其作为环境污染物的潜在风险也逐渐浮出水面,引起了全球的关注。随着COVID-19大流行期间DEX需求的激增,其在环境中的排放量也随之增加,对生态系统构成了严重威胁。DEX不仅在医疗环境中被排放,还广泛存在于我们的食品、药物、护肤品和水资源中,人类和动物可能通过多种途径直接或间接地暴露于DEX。研究表明,母体在孕期暴露于DEX会对子代的学习能力、工作记忆、自我认知和情绪状态产生长期不良影响,并可能改变其成年时大脑的微观结构。但是,关于DEX早期生命阶段暴露与出生后神经行为结果之间的联系机制的研究仍然滞后。
近日,武汉大学药学院徐丹教授课题组在Environment International杂志上发表了题为Dexamethasone as an emerging environmental pollutant: Disruption of cholesterol-dependent synaptogenesis in the hippocampus and subsequent neurobehavioral impacts in offspring的研究成果(全文链接:https://www.sciencedirect.com/science/article/pii/S0160412024006500),为我们揭示了这一联系。该研究证实,孕期地塞米松暴露(Prenatal dexamethasone exposure, PDE)子代在幼年期即出现认知和情感障碍性神经行为缺陷,并且这种损害持续到成年期。该影响机制主要涉及PDE损害子代海马区神经元突触的形成,其中一个关键原因是胆固醇供给不足,这种不足损害了神经元膜的稳定性,进而影响了突触的正常形成,最终引起认知及情感缺陷。

考虑到DEX通过多种途径进入机体循环的复杂性,为确保剂量的精确性,该研究选择在孕中晚期通过皮下注射的方式使用0.2 mg/kg·d的DEX进行处理。通过观察幼年期和成年期子代行为学变化,该研究确定了PDE的影响是持久的,影响子代从幼年到成年的情绪和认知功能。
突触作为神经元信息传递的枢纽,对于发育期胎儿通过建立结构完善、功能正常的突触网络来完成记忆获取和情绪反应至关重要。作者利用透射电镜和免疫荧光等手段观察发现PDE出生后子代存在海马神经突触结构异常、神经递质载体突触小泡减少,并且伴随脂筏损伤。宫内是胎鼠大脑和神经系统发育的关键时期,此时突触生成加速,初步的突触连接为后续完整神经网络的构建提供了必要的结构基础。作者进一步探究发现PDE子代的脂筏损伤及突触损害,在宫内期间就已显著存在,即这种损害具有宫内发育起源。
胆固醇作为神经元细胞膜和突触小泡的关键结构成分,其水平变化直接影响突触的强度和可塑性。星形胶质细胞是中枢主要的胆固醇合成细胞,神经元的胆固醇主要依赖于星形胶质细胞的合成。作者通过提取海马原代星形胶质细胞,发现在PDE子代无论是出生前还是出生后,海马的胆固醇稳态都发生了改变,主要表现为星形胶质细胞内的胆固醇含量增加,而细胞外胆固醇含量减少。这种改变可能与胆固醇外排转运体ATP 结合盒亚家族 G 成员 1 (ATP binding cassette subfamily G member 1, ABCG1)的表达和功能抑制相关。为进一步确定ABCG1的作用,作者利用体外实验证实DEX直接调控了胎鼠海马星形胶质细胞中ABCG1的表达,并影响了星形胶质细胞胆固醇的外排。随后作者提取了海马原代神经元,将其与星形胶质细胞进行共培养,发现星形胶质细胞中ABCG1抑制所引起的胆固醇外排减少,直接导致了神经元的胆固醇供应不足。过表达星形胶质细胞中的ABCG1,可以缓解这种因胆固醇外排减少导致的神经突触损伤。
宫内发育的关键时期易受到表观遗传调控的影响, 表观遗传机制可以很好的解释宫内生长受限相关表型的编程。作者对PDE胎海马原代星形胶质细胞进行了一系列乙酰化酶的筛选,发现组蛋白乙酰转移酶 1 (Histone Acetyltransferase 1, HAT1)的表达在PDE出生前、后子代中均显著降低。DEX处理的原代星形胶质细胞中HAT1亦显著降低,细胞水平敲低HAT1进一步证实HAT1参与调控ABCG1的表达。鉴于HAT1负责催化新生组蛋白H4的第5位(H4K5)和第12位(H4K12)赖氨酸的乙酰化,且这种乙酰化作用在物种间高度保守,作者随后的验证实验发现PDE子代中Abcg1启动子区H4K5ac和H4K12ac水平降低,且这种降低状态持续至出生后,体外实验也出现一致性结果。
miRNAs表达丰富,靶向基因种类多,且具有遗传高度保守的特点。为了确定miRNAs是否参与PDE子代海马ABCG1表观遗传修饰的调控,作者利用miRNA测序筛选发现PDE胎鼠海马miR-450a-3p的表达上调最为显著,并且双荧光素酶报告基因证实了miR-450a-3p与Hat1之间存在直接的负调控关系。进一步通过干扰miRNA以及星形胶质细胞与神经元的共培养体系发现,抑制miR-450a-3p能够缓解由于星形胶质细胞胆固醇外排减少引起的神经元胆固醇不足及突触和脂筏功能损伤。
DEX作为长效糖皮质激素,通过激活糖皮质激素受体(Glucocorticoid receptor, GR)发挥生物学效应。作者发现PDE子代存在海马星形胶质细胞GR活化,通过生物信息学分析及GR拮抗剂RU486干扰实验,进一步证实GR激活通过结合在miR-450a启动子区糖皮质激素反应元件(glucocorticoid response element, GRE)位点,最终调控miR-450a-3p的表达。RU486也逆转了DEX引起的胎海马星形胶质细胞HAT1/ABCG1信号轴的变化及细胞内外胆固醇含量的改变。进一步的共培养实验证实RU486能够缓解由PDE引起的神经元胆固醇含量减少以及突触和脂筏的损伤。
综上,该研究证实PDE子代海马星形胶质细胞中GR的异常激活,触发了miR-450a-3p/HAT1/ABCG1信号轴的变化,导致星形胶质细胞中胆固醇的外排障碍及神经元胆固醇供应不足,进一步导致突触形成受损。这揭示了DEX如何干扰胆固醇的正常调节,从而导致突触形成障碍和行为缺陷。该研究不仅强调了孕期环境污染因素对子代长期健康的重要影响,也扩展了对孕期糖皮质激素暴露对子代大脑发展影响的科学理解,并为胎源性认知与情感障碍性疾病的干预提供了新的见解。
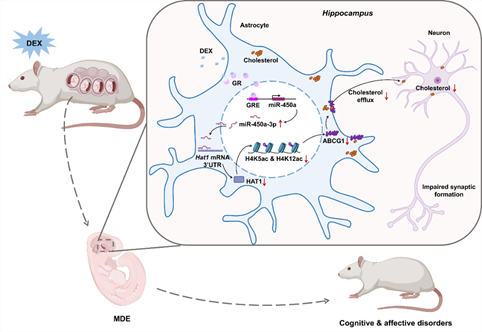
Graphical abstract: Abnormal GR/miR-450a-3p/HAT1/ABCG1 signaling axis causes long-term cognitive and emotional neurobehavioral changes in PDE offspring by blocking cholesterol efflux in hippocampal astrocytes. DEX, dexamethasone; MDE, maternal dexamethasone exposure; GR, glucocorticoid receptor; GRE, glucocorticoid response element; HAT1, histone acetyltransferase 1; ABCG1, ATP-binding cassette transporter G1.
该研究是发育源性疾病湖北省重点实验室的又一代表性成果。武汉大学药学院徐丹教授为该文章的独立通讯作者,武汉大学基础医学院2018级硕士生戴诗韵和武汉大学药学院2022级博士生骆名翠为共同第一作者。该研究得到了国家自然科学基金优秀青年项目(82122071)和国家重点研发计划(2020YFA0803900)的资助。