
-

生物通官微
陪你抓住生命科技
跳动的脉搏
格局打开:原位重编程癌细胞 “化敌为友”转为抗原呈递细胞 重编程<2%的细胞足以触发肿瘤消退!
【字体: 大 中 小 】 时间:2024年10月18日 来源:AAAS
编辑推荐:
癌细胞可以在体内被重新编程为免疫原性cDC1样抗原呈递细胞,可以激活T细胞并促进抗肿瘤免疫,克服了肿瘤微环境,化敌为友,为未来基于树突状细胞的免疫疗法铺平了道路。
癌症免疫治疗的成功取决于肿瘤特异性T细胞的启动。然而,肿瘤细胞经常下调抗原呈递,并建立一个免疫抑制微环境,将免疫原性抗原呈递细胞排除在肿瘤之外,阻断免疫细胞(树突状细胞和T淋巴细胞)的激活和破坏肿瘤的能力,阻碍了包括免疫检查点阻断在内的癌症免疫疗法。树突状细胞(DC)是肿瘤微环境(TME)中重要的免疫调节因子——负责从肿瘤细胞中捕获蛋白质并将其呈递给T细胞,T细胞随后被激活并成为肿瘤杀伤细胞。因此,操纵树突状细胞是一种很有前途的癌症免疫治疗策略,但是操纵广泛的DC亚型和获得治疗规模所需的细胞类型方面均存在挑战。树突状细胞的一个亚类——1型常规树突状细胞 (cDC1s) 是一种罕见的树突状细胞亚群,对于启动肿瘤消除免疫反应特别重要,是募集和激活细胞毒性T细胞的关键,它们在肿瘤中的存在与生存率的提高有关。来自瑞典隆德大学的研究人员在新一期《Science》报告,癌细胞可以在体内被重新编程为免疫原性cDC1样抗原呈递细胞,这种细胞可以激活T细胞并促进抗肿瘤免疫。这种方法克服了肿瘤微环境中cDC1数量的限制,为未来基于树突状细胞的免疫疗法铺平了道路。
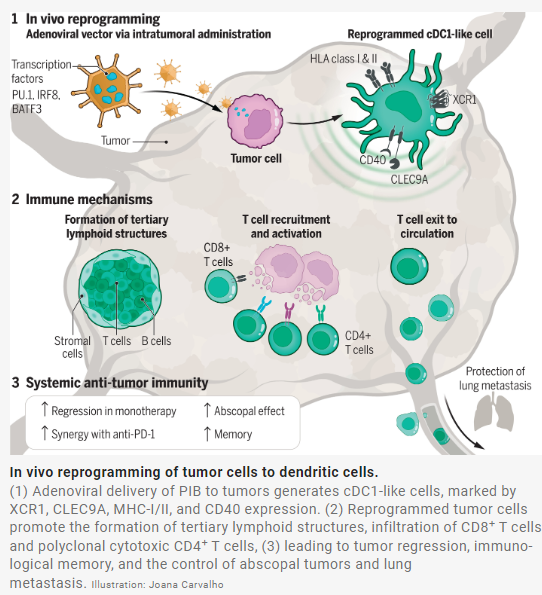
既往研究表明,转录因子PU.1、IRF8和BATF3(PIB)可在体外9天内直接将成纤维细胞或肿瘤细胞重编程为抗原呈递的cDC1样细胞。然而,这些重编程细胞的离体操作和再给药对临床应用构成了一定挑战。来自瑞典隆德大学的研究人员想尝试是否能在肿瘤微环境中将肿瘤细胞重编程为cDC1样细胞。
Ascic等人通过腺病毒载体传递转录因子PU.1、IRF8和BATF3,开发了一种在体内直接将癌细胞重编程为树突状细胞的方法。转录因子促进了树突状细胞样功能,使工程肿瘤细胞能够呈递抗原并装载癌症特异性T细胞免疫反应。利用同源模型、异种移植物和来自多种癌症类型的人类癌症球体的组合,他们表征了由重编程触发的局部和全身免疫反应,证实从肿瘤细胞转变到cDC1免疫细胞的“重编程”重塑了肿瘤微环境,引发肿瘤消退和全身免疫。他们还开发了一个将转录因子PU.1、IRF8和BATF3直接递送到肿瘤的病毒平台。
与体外方法相比,体内肿瘤细胞重编程表现出更快的动力学和更高的保真度,并导致肿瘤驻留的cDC1样细胞显示出成熟的免疫原性特征。尽管存在免疫抑制的癌症相关成纤维细胞、髓源性抑制细胞或周细胞,但在人类癌症球体中,重编程有效地进展,导致T细胞活化和肿瘤细胞消除。在小鼠免疫能力模型中,重编程肿瘤细胞在肿瘤内招募和扩增多克隆细胞毒性和记忆T细胞,同时减少耗竭和调节群体。观察到含有B细胞、T细胞和基质细胞的三级淋巴结构的形成,将免疫反应从“冷”转变为“热”。免疫重塑导致肿瘤消退是独立于内源性cDC1的。CD4+ T细胞被认为是关键的介质,因为用抗体消耗CD4+ T细胞会导致消除治疗反应。此外,体内重编程在具有不同免疫原性和免疫检查点阻断反应性的黑色素瘤模型中建立了肿瘤特异性全身免疫和免疫记忆。除了单一治疗效果外,还观察到与抗程序性细胞死亡蛋白1(抗PD -1)或抗细胞毒性T淋巴细胞相关蛋白4(抗CTLA-4)免疫疗法的显著协同作用。研究进一步证实,重编程<2%的细胞足以触发肿瘤消退,支持肿瘤内重编程因子的传递。
结论
研究表明,使用腺病毒载体原位递送转录因子PU.1、IRF8和BATF3诱导肿瘤内cDC1样细胞的产生,导致肿瘤微环境的重塑,三级淋巴样结构的形成,以及多克隆细胞毒性和记忆T细胞的扩增。这项工作为一种现成的肿瘤特异性免疫疗法提供了临床前概念证明,这种疗法可以协调全身和持久的抗肿瘤免疫。
讨论
Ascic等人开创性地开发了一种方法,通过基于腺病毒的递送编码cDC1分化和功能必需蛋白的PU.1、IRF8和BATF3三个基因,让肿瘤细胞在体内被基因重新编程为cDC1样细胞。这种策略称为PIB,使肿瘤细胞能够以cDC1s的形式呈递抗原,重塑TME,招募和扩增多克隆细胞毒性T细胞。在几种黑色素瘤小鼠模型中抑制肿瘤生长并引发长期全身免疫。尽管癌细胞的原位(局部)转化效率低于体外转化,但仅0.06%的重编程细胞就足以引发持久的抗肿瘤反应,这表明这些cDC1样细胞具有强大的抗肿瘤潜力。
为了评估体内重编程的cDC1样细胞的功能能力,研究人员表征了它们对TME重塑的影响,其中包括多种免疫细胞类型、癌症相关成纤维细胞、内皮细胞和其他组织驻留细胞类型。PIB重编程的cDC1样细胞招募并激活了大量的细胞毒性和记忆性T细胞,并限制了可促进肿瘤进展的调节性T细胞的数量。尤其是CD4+T细胞对促进抗肿瘤免疫至关重要,因为这一群体的消耗大大削弱了重编程cdc1样细胞的肿瘤消退作用。因此,将肿瘤细胞重编程为cDC1样细胞将TME转化为一种免疫原性微环境,可拮抗肿瘤生长。此外,重编程的cDC1样细胞主要在原位发挥功能,最大限度地降低了免疫治疗期间可能发生的系统性炎症反应(如细胞因子风暴)和严重不良反应的风险。
Ascic通过体外评估含有癌症相关TME成分的人肿瘤细胞球,进一步验证了PIB三因子介导的人肿瘤细胞重编程的作用。值得注意的是,癌细胞原位重编程为cDC1样细胞及其抗肿瘤功能都不受球体中免疫抑制TME的影响。这很重要,因为TME对正常免疫反应的强烈抑制作用解释了各种免疫疗法的失败。这些结果表明,将肿瘤细胞在体内重编程为cDC1样细胞可能具有治疗潜力,包括作为相对容易治疗的免疫炎性肿瘤的单一疗法。当与其他免疫疗法联合使用时,这种策略也可能k可改善“免疫沙漠"肿瘤(那些缺乏免疫细胞的肿瘤)治疗——这些肿瘤通常不响应免疫检查点阻断疗法。此外,在免疫缺陷小鼠中实现了pib介导的人类异种移植肿瘤向cDC1样细胞的重编程,支持了使用该策略在体内对人类肿瘤进行重编程的潜力。然而,还需要一种更接近人类免疫模型的人源化小鼠系统,以全面评估这种将肿瘤细胞重编程为cDC1样细胞的体内有效性。
直接将宿主癌细胞转化为功能性免疫细胞,而不需要体外细胞制造,这是一种潜在的现成的个性化治疗方法。例如,嵌合抗原受体T细胞(CAR-T)是一种经过修饰的宿主T细胞,可以特异性和有效地杀死肿瘤细胞,在体内产生的CAR-T细胞已经成功地用于临床前研究。 虽然重编程T细胞在治疗某些肿瘤方面已经取得了临床成功,但DC可以启动抗肿瘤T细胞反应,因此具有治疗多种癌症的潜力。 然而,此前基于DC的抗肿瘤治疗尚未取得实质性进展。Ascic开发的原位癌细胞重编程策略克服了体外细胞操作的局限性,并支持将癌细胞重编程为体内特异性免疫细胞作为一种有希望的癌症治疗方法。未来的研究,包括使用人源化动物模型和临床试验的研究,将需要评估该方法在不同肿瘤环境中的疗效、效率和准确性。
 生物通微信公众号
生物通微信公众号
知名企业招聘