
-

生物通官微
陪你抓住生命科技
跳动的脉搏
我院陈洪敏教授团队在肿瘤超低剂量放疗等效减毒新策略方面取得重要进展
【字体: 大 中 小 】 时间:2024年10月13日 来源:厦门大学 公共卫生学院
编辑推荐:
近日,我院陈洪敏教授团队在期刊Nature Communications 上发表了题为“Biodegradable copper-iodide clusters modulate mitochondrial function and suppress tumor growth under ultralow-dose X-ray irradiation”的研究成果
近日,我院陈洪敏教授团队在期刊Nature Communications上发表了题为“Biodegradable copper-iodide clusters modulate mitochondrial function and suppress tumor growth under ultralow-dose X-ray irradiation”的研究成果。该研究构建了一种生物可降解的铜碘簇纳米颗粒,该纳米颗粒在实现超低剂量放疗的同时,在肿瘤环境下分解铜离子和碘离子,有效调节线粒体功能,放大氧化应激,并激活Bcl-2途径,为癌症治疗提供新的治疗策略。
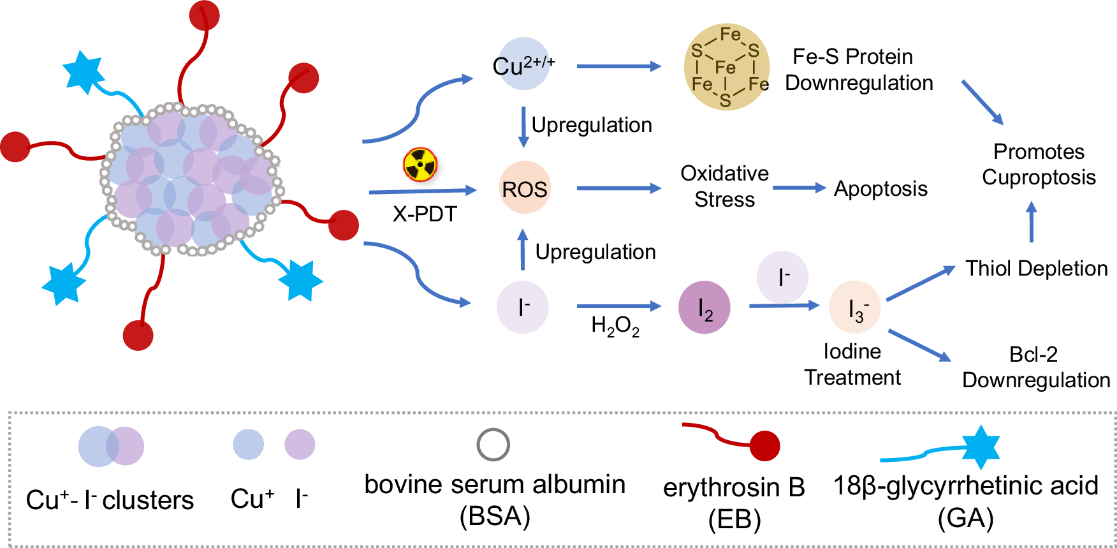
X射线诱导的光动力疗法(X-PDT)利用X射线激发荧光体并传递给光敏剂,产生活性氧。而基于铜-碘簇的纳米粒,可增强吸收放射线同时高效转换放射能量为光能,具有良好光学可调性。铜离子和碘离子二者是所有生物体内重要的元素,而提高细胞内的铜离子或碘离子的浓度可以有效抑制肿瘤生长。铜死亡(Cuproptosis)是一种依赖于线粒体呼吸,通过铜过载诱导的新型细胞程序性死亡形式。而碘也可以作为预防癌症,研究表明临床碘化造影剂增加了放射诱导的癌细胞死亡;碘还在硫醇氧化还原系统中起作用,这有助于维持细胞中最佳的氧化还原平衡。
本研究利用血清蛋白稳定铜-碘簇,增强生物安全性,具有明亮的放射发光性能。血清蛋白表面功能基团可共价偶联匹配辐射荧光发射的光敏剂赤藓红B (EB) 和靶向分子GA (Cu-I@BSA-EBGA)。体外和体内研究表明:(1) X-PDT过程诱导产生活性氧ROS: Cu-I@BSA-EBGA 通过主动靶向富集到肿瘤区域,在远低于临床放射剂量 2 Gy辐照下(临床常用剂量50 Gy左右),X-PDT过程诱导产生活性氧ROS。(2) 释放铜离子,诱导铜死亡机制:Cu-I@BSA-EBGA在肿瘤区域发生降解,释放Cu+和I-离子,而这两种离子可以分别与H2O2反应,生成Cu2+/+和I2/I3-。(3) 释放碘离子,诱导碘相关治疗机制并促进铜死亡过程。该过程通过调节线粒体功能,损伤 DNA,减少 ATP 生成和增强氧化应激来诱导细胞死亡。目前尚无利用这种氧化还原反应在细胞内原位生成过量碘合物用于治疗的报道,为肿瘤治疗等效减毒基础研究拓展了新策略。团队正深入挖掘这一策略,并推动其转化研究工作。
我院博士研究生马晓倩、硕士研究生林诺、杨晴为该论文共同第一作者,我院陈洪敏教授为论文通讯作者。该研究得到了科技部重点研发计划、国家自然科学基金、福建省杰出青年基金、翔安创新实验室/传染病疫苗研发全国重点实验室培育项目等的支持。
论文链接:https://www.nature.com/articles/s41467-024-52278-6