
-

生物通官微
陪你抓住生命科技
跳动的脉搏
清华大学基础医学院丁强课题组建立基于水疱性口炎病毒载体的复制型重组SADS-CoV冠状病毒细胞...
【字体: 大 中 小 】 时间:2024年10月13日 来源:清华大学医学院
编辑推荐:
清华大学基础医学院丁强课题组建立基于水疱性口炎病毒载体的复制型重组SADS-CoV冠状病毒细胞模型基础医学 清华大学基础医学院近些年来,冠状病...
基础医学 清华大学基础医学院
近些年来,冠状病毒感染在人类和动物中频繁出现,因此有必要预防病毒从动物到人类的传播风险1。2016年,我国广东省爆发了猪急性腹泻综合征冠状病毒(SADS-CoV),导致5日龄以下仔猪死亡率高达90%。SADS-CoV是一种单股正链RNA病毒,属于冠状病毒科a冠状病毒属,其基因组大小约为27.2 kb,与菊头蝠冠状病毒HKU2的核苷酸序列同一性为95%2-4。SADS-CoV在体外条件下,能够感染包括蝙蝠、小鼠、大鼠、沙鼠、仓鼠、猪、鸡、非人类灵长类动物以及人类的细胞系5,呈现出广泛的物种嗜性,具有跨物种传播的潜在风险。然而,由于缺乏研究病毒入侵的工具以及缺乏疫苗或抗病毒疗法,使这种威胁持续存在。
水疱性口炎病毒(Vesicular stomatitis virus,VSV)载体经过基因工程改造,已成为一个安全、高效的疫苗载体。VSV病毒载体可以高效地利用非同源的病毒蛋白进行假型化(pesudotyped),用于那些难以体外培养、致病性强的病原体,在研究病毒颗粒入侵、筛选抗病毒药物以及疫苗开发方面有着广泛的应用6-8。
近日,清华大学基础医学院丁强课题组在《Journal of Virology》发表题为《Establishment of replication-competent vesicular stomatitis virus recapitulating SADS-CoV entry》的研究论文。该研究建立了携带新型猪急性腹泻综合征冠状病毒(SADS-CoV)刺突蛋白基因的复制型重组VSV病毒(VSV-SADS spike),该模型可模拟SADS-CoV入侵宿主细胞,且可在小鼠体内诱导针对SADS-CoV spike的中和抗体,显示其作为病毒载体疫苗的潜力。丁强课题组博士研究生朱子慧设计了VSV的感染性分子克隆,用SADS-CoV spike基因替换其糖蛋白(G)基因,并在3'前导区插入Venus报告基因(图1A),以生成具有复制能力的重组rVSV-Venus-SADS S病毒。将基因组质粒和表达N、P、G、M、L和T7 RNA聚合酶的辅助质粒转染进HEK293T细胞中。收获转染4天后的上清用于感染Huh7.5.1细胞,然而初始的感染信号比较弱,这意味着P0中的病毒产量相对较低。研究人员将rVSV-Venus-SADS S病毒在Huh7.5.1细胞中进行了连续传代,以获得适应性突变病毒(图1B)。
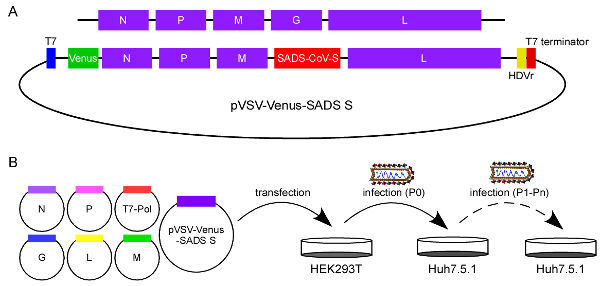
图1 设计和拯救复制型rVSV-Venus-SADS S病毒
通过对P6代病毒基因组测序发现,在S蛋白C端胞质区发生了一个点突变,该突变将原始Q1120突变为终止密码子,导致翻译终止。这导致S蛋白C端末尾11个氨基酸缺失,缩写为S?11。为了评估这种突变是否赋予了适应性表型,研究人员拯救了rVSV-Venus-SADS S?11病毒,发现其具有更强的感染能力(图2A)。通过分析S和S?11的表达分布,发现S?11蛋白具有更高地定位到细胞膜的能力,使其更有效地融入VSV病毒颗粒。进一步地,研究人员证明rVSV-Venus-SADS S?11的感染可以被SADS-CoV S1多克隆抗体特异性抑制,而rVSV-Venus-SARS-CoV-2 S不受影响(图2B)。这一观察结果表明rVSV-Venus-SADS S?11感染是由SADS-CoV刺突蛋白介导。从而验证了该重组病毒在研究SADS-CoV入侵和评估抗病毒策略方面的实用性。
图2 重组VSV-SADS病毒的生长曲线和中和曲线
基于重组VSV的疫苗平台已成功用于多种病毒,例如已经上市的rVSV-ZEBOV疫苗。因此,研究人员旨在确定rVSV-Venus-SADS S?11作为小鼠模型中潜在疫苗候选物的免疫原性。为了评估对rVSV-Venus-SADS S?11的免疫反应,研究人员用8×106 FFU的rVSV-Venus-SADS S?11免疫6周龄C57BL/6雌性小鼠,而对照组接受PBS。在初次接种14天后,通过肌肉注射的途径接种相同剂量的加强针(图3A)。与接种前相比,初免和加强免疫可诱导针对rVSV-Venus-SADS S?11感染的有效中和抗体。此外,其中五只小鼠接种加强针后体内产生了针对SADS-CoV真病毒感染的中和抗体(图3B)。
图3 VSV-SADS免疫小鼠诱导产生针对SADS-CoV的中和抗体
综上所述,该研究成功开发了一种基于安全实用的工具,用于研究SADS-CoV细胞进入和探索重组VSV载体SADS-CoV疫苗的潜力。这些工具为未来开发针对 SADS-CoV和类似新兴病毒的预防性干预措施铺平了道路。
清华大学基础医学院丁强副教授是该研究论文的通讯作者。课题组博士生朱子慧为该论文的第一作者,博士生龚明丽和孙波参与了此工作。复旦大学张荣教授和韩雨桐同学也为研究提供重要支持。
该研究得到了国家自然科学基金(82341084、82272302、82241077和32070153)、国家重点研发计划(2021YFC2300200-04和2023YFC2305900)、北京市自然科学基金(Z220018)、清华大学万科公共卫生与健康学科发展专项基金(2022Z82WKJ013)以及山西医科大学-清华大学医学院前沿医学协同创新中心的支持。
参考文献:
Carlson, C.J., Albery, G.F., Merow, C., Trisos, C.H., Zipfel, C.M., Eskew, E.A., Olival, K.J., Ross, N., and Bansal, S. (2022). Climate change increases cross-species viral transmission risk. Nature 607, 555-562. 10.1038/s41586-022-04788-w.
Gong, L., Li, J., Zhou, Q., Xu, Z., Chen, L., Zhang, Y., Xue, C., Wen, Z., and Cao, Y. (2017). A New Bat-HKU2-like Coronavirus in Swine, China, 2017. Emerg Infect Dis 23. 10.3201/eid2309.170915.
Zhou, P., Fan, H., Lan, T., Yang, X.L., Shi, W.F., Zhang, W., Zhu, Y., Zhang, Y.W., Xie, Q.M., Mani, S., et al. (2018). Fatal swine acute diarrhoea syndrome caused by an HKU2-related coronavirus of bat origin. Nature 556, 255-258. 10.1038/s41586-018-0010-9.
Hu, B., Zeng, L.P., Yang, X.L., Ge, X.Y., Zhang, W., Li, B., Xie, J.Z., Shen, X.R., Zhang, Y.Z., Wang, N., et al. (2017). Discovery of a rich gene pool of bat SARS-related coronaviruses provides new insights into the origin of SARS coronavirus. PLoS Pathog 13, e1006698. 10.1371/journal.ppat.1006698.
Yang, Y.L., Qin, P., Wang, B., Liu, Y., Xu, G.H., Peng, L., Zhou, J., Zhu, S.J., and Huang, Y.W. (2019). Broad Cross-Species Infection of Cultured Cells by Bat HKU2-Related Swine Acute Diarrhea Syndrome Coronavirus and Identification of Its Replication in Murine Dendritic Cells In Vivo Highlight Its Potential for Diverse Interspecies Transmission. J Virol 93. 10.1128/JVI.01448-19.
Liu, G., Cao, W., Salawudeen, A., Zhu, W., Emeterio, K., Safronetz, D., and Banadyga, L. (2021). Vesicular Stomatitis Virus: From Agricultural Pathogen to Vaccine Vector. Pathogens 10. 10.3390/pathogens10091092.
Dieterle, M.E., Haslwanter, D., Bortz, R.H., 3rd, Wirchnianski, A.S., Lasso, G., Vergnolle, O., Abbasi, S.A., Fels, J.M., Laudermilch, E., Florez, C., et al. (2020). A replication-competent vesicular stomatitis virus for studies of SARS-CoV-2 spike-mediated cell entry and its inhibition. bioRxiv. 10.1101/2020.05.20.105247.
Case, J.B., Rothlauf, P.W., Chen, R.E., Kafai, N.M., Fox, J.M., Smith, B.K., Shrihari, S., McCune, B.T., Harvey, I.B., Keeler, S.P., et al. (2020). Replication-Competent Vesicular Stomatitis Virus Vaccine Vector Protects against SARS-CoV-2-Mediated Pathogenesis in Mice. Cell Host Microbe 28, 465-474 e464. 10.1016/j.chom.2020.07.018.
论文链接:
https://journals.asm.org/doi/10.1128/jvi.01957-23?url_ver=Z39.88-2003